
全身性硬化症(全身性強皮症)に伴う間質性肺疾患(SSc-ILD)に対する治療戦略 ~膠原病に伴う間質性肺疾患(CTD-ILD)診断・治療指針2025より~(静止画)
サイトへ公開:2025年06月27日 (金)
クイックリンク

2025年4月、日本呼吸器学会・日本リウマチ学会の共同編集による「膠原病に伴う間質性肺疾患 診断・治療指針 2025」(以下、CTD-ILD診断・治療指針2025年版)が発刊されました1)。CTD-ILD診断・治療指針2025年版では、全身性硬化症(全身性強皮症)に伴う間質性肺疾患(SSc-ILD)の治療アルゴリズムが改訂されました。
今回は、CTD-ILD診断・治療指針2025年版で提案されたSSc-ILDの治療アルゴリズムを中心に、SScに合併するILDの診断・治療介入の重要性について解説します。
SScとSSc-ILDの推定患者数
近年の早期診断・治療介入、治療戦略の進歩などにより多くの結合組織病(膠原病)(CTD)患者の予後は改善しつつありますが、SScは依然として予後不良な難治性病態です。欧州強皮症臨床試験・研究グループ(EUSTAR)データベースによる研究では、SSc関連死の原因としてILDの1つである肺線維症(pulmonary fibrosis)が最も多く、約3割に及ぶことが示唆されています2)。
それでは、わが国において、SSc患者さんのうちどのくらいの割合でILDを発症し、また発症したSSc-ILDのうちどのくらいの割合が進行性線維化を伴う間質性肺疾患(PF-ILD)に進展するのでしょうか。
令和5年度末現在、特定医療費(指定難病)受給者証を交付された約2.7万人のSSc患者さんのうち、海外のILD有病率のデータから推算すると約半数がILDを発症すると予想されます3,4)。さらに、日本を含む7ヵ国の呼吸器専門医、リウマチ専門医、内科医を対象としたアンケート調査では、SSc-ILD患者さんのうち31%がPF-ILDに進展すると推定されたため5)、わが国のSSc-ILD患者さん約1万3千人のうち約4千人がPF-ILDに該当すると概算できるでしょう(図1)。
図1

CTD-ILD診断・治療指針2025におけるSSc-ILDの治療アルゴリズム
Goh分類による疾患挙動の確認
SSc患者さんに対しては日常診療において常にILD発症の可能性を念頭に置き、SSc-ILDの診断および予後予測を行うことが求められます。では、SSc-ILDで治療介入が必要な患者さんはどのように見極めればよいのでしょうか。
2025年に5年ぶりに改訂された『膠原病に伴う間質性肺疾患 診断・治療指針 2025』(CTD-ILD診断・治療指針2025年版)では、以下の治療アルゴリズムが提案されています(図2)1)。
図2
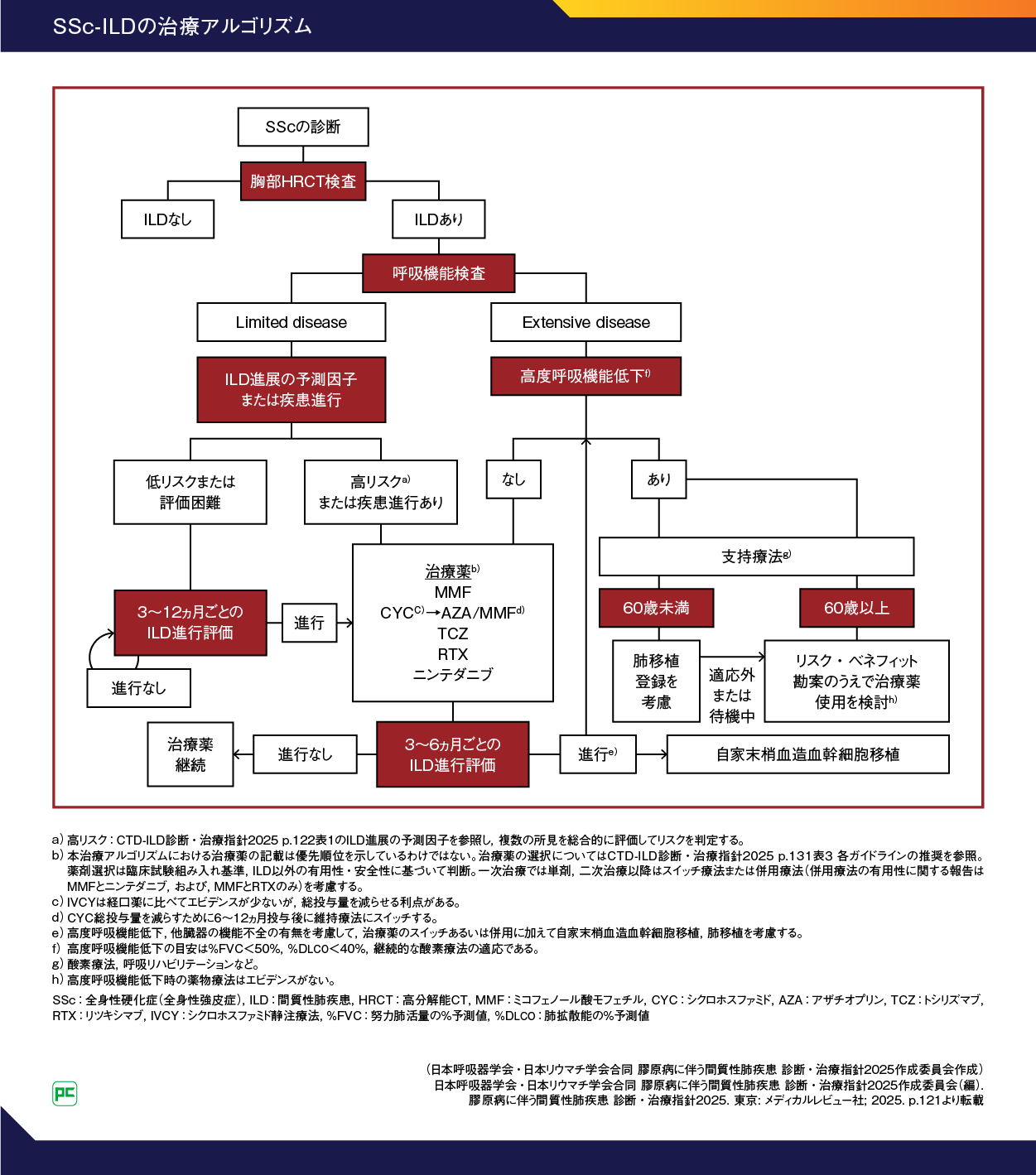
SScでILDありと診断された場合、胸部高分解能CT(HRCT)所見と呼吸機能検査によってLimited diseaseあるいはExtensive diseaseに病期分類を行います。
Limited diseaseあるいはExtensive diseaseに分ける病期分類はGohらによって提唱されたもので、診断時の胸部HRCT所見における病変範囲と呼吸機能検査による努力性肺活量(%FVC)を組み合わせて行います6, 7)。
Goh分類では、SSc-ILDと診断された患者に対して、胸部HRCTでの病変範囲が20%<、または病変範囲が判定不能で%FVCが≧70%の症例をLimited diseaseとし、胸部HRCTでの病変範囲が>20%、または病変範囲が判定不能で%FVC が<70%の症例をExtensive diseaseとしています。
病期別に生存率を比較すると、Limited diseaseと比較してExtensive diseaseで生存率が有意に低いことが示唆されています(図3、HR 3.09、95%CI 1.93-4.94、log-rank検定、p<0.0001)7)。
図3

Extensive diseaseに分類された症例は、すでに高度呼吸機能低下があるケースを除いて、治療薬による介入の対象となります。
一方、Limited diseaseと分類された症例でも、ILD進展の予測因子または疾患進行を評価し、高リスクまたは進行疾患が認められた場合は治療薬による介入の対象となります。低リスクまたは評価困難であっても、3~12ヵ月ごとのILD進行評価の結果、線維化の進行が認められれば治療薬による介入を行います。
なお、初版の『膠原病に伴う間質性肺疾患 診断・治療指針 2020』では、Limited diseaseの低リスク例に対する評価頻度は「6~12ヵ月ごと」と記載されていました8)。今回の改訂では、最新のガイドラインや本邦のコンセンサスステートメントなどに基づき「3~12ヵ月ごと」に変更されたことで、より頻回の定期的評価が求められると考えられます。
SSc-ILD診療における胸部HRCT検査の有用性
SSc-ILDのスクリーニング、診断、重症度評価において、胸部HRCT検査は従来の胸部CT検査や呼吸機能検査よりも感度が高いため、今回の改訂においてもILDのリスクが高いSSc患者での胸部HRCT検査によるスクリーニングが推奨されています1)。SSc-ILD患者の胸部HRCT所見を提示します(図4)9)。
図4
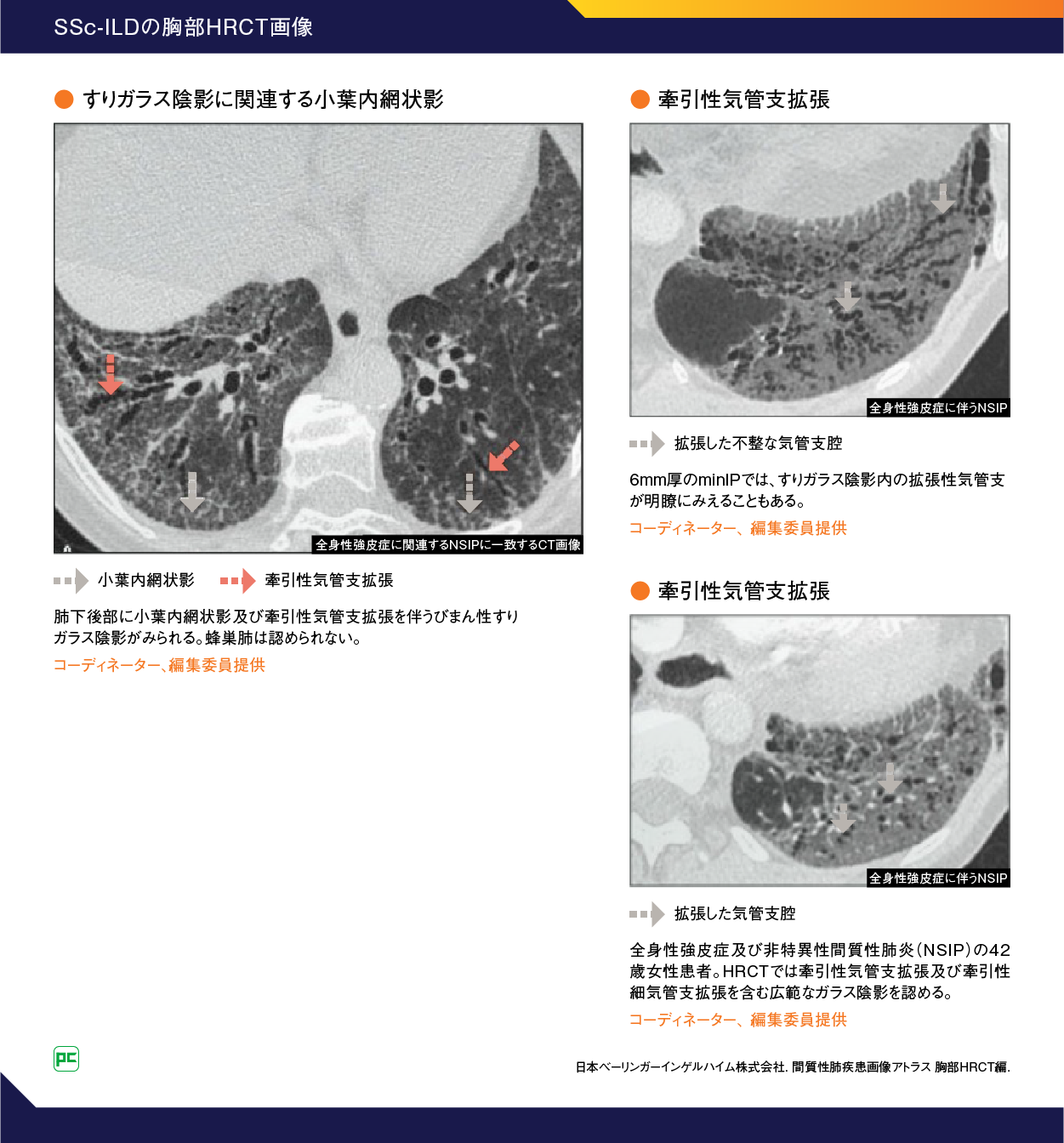
SSc-ILDの胸部HRCT所見は特発性非特異性間質性肺炎(iNSIP)と類似の非特異性間質性肺炎(NSIP)パターンを呈し、すりガラス影主体、すりガラス影と網状影の混在が主で、蜂巣肺形成はまれとされています10)。
また、SSc-ILD患者でみられるすりガラス影は経過のなかで牽引性気管支拡張へと変化することがあります10)。このように、すりガラス影が牽引性気管支拡張へと進行する理由として、すりガラス影が炎症だけでなく小葉内の線維化を反映していることが要因と推測されています 11)。
SScでみられるNSIPパターンの線維化は、びまん性といってもやや強弱があることが多く、炎症細胞浸潤に乏しい時相の均一な慢性線維化がやや小葉/細葉辺縁優位に分布し、細かな網目状に繋がるような像が1つの典型像となります1)。
SSc-ILDにおける進展予測因子
前述の治療アルゴリズムでLimited diseaseに分類された症例でも、ILDへと進展するリスクが高い場合は治療介入の対象となります。ILD進展のリスク因子は、初版の2020年の指針では喫煙歴(Smoking)・年齢(Age)・肺拡散能(DLco)をスコア化して合計の値からリスクを3段階で評価するSADL model、6分間歩行テスト後の経皮的酸素飽和度(SpO2)低下・関節炎(arthritis)のエピソードを評価して0点または1点で点数化し、その合計点から1年後のILD進行を予測するSPAR model、KL-6高値(>1,273U/mL)の3点が記載されていました8)。
今回の改訂では、ILD進展の予測因子として従来のSADL modelやSPAR model、KL-6高値などを含む複数の項目がまとめて記載される形に変更となりました(表1)1)。
表1

これらのうち、複数の予後不良因子をもつSSc患者では疾患の進行を確認せずとも治療開始を検討する必要があります。特に、「SSc発症から罹病期間が短く、dcSScの患者(early diffuse cutaneous SSc)は特にILD進行に注意が必要である」との記載があります1)。SSc発症の最初の3年以内にILD が出現した場合、予後不良の可能性が示唆されており12,13)、SSc患者のILD進展予測においては罹病期間に注意を払う必要があります。
各ガイドラインが推奨するSSc-ILDの治療方針
近年、SSc-ILD領域において複数のランダム化比較試験が施行され、治療選択肢が増加しています。
2023年に発表された米国胸部学会(ATS)のガイドラインでは、SSc-ILDの治療選択肢としてまずミコフェノール酸モフェチル(MMF)が強く推奨され、次にシクロホスファミド(CYC)、リツキシマブ(RTX)、トシリズマブ(TCZ)、オフェブ、オフェブとMMFの併用が条件付きで提案されました(表2)14)。
一方、米国リウマチ学会(ACR)/米国胸部疾患学会(CHEST)2023 ガイドラインでは、SSc-ILDの初期治療としてMMF、TCZ、RTXが推奨され、追加選択肢としてCYC、オフェブ、アザチオプリン(AZA)が挙げられています(表2)15)。
米国の専門家によるコンセンサスステートメントでは、MMFがSSc-ILD患者の第一選択薬として推奨され、重度または進行性のSSc-ILD患者で免疫抑制療法が効果を示さない場合にMMF、CYC、TCZへの追加治療としてオフェブを考慮すること、さらに5年以上経過したSSc患者で進行性ILDがあり免疫抑制療法が推奨されない場合に、オフェブの初期単剤療法も合意されました16)。
欧州リウマチ学会(EULAR)2023の推奨では、SSc-ILDの一次治療としてMMF、CYC、RTX、オフェブ、オフェブとMMFの2剤併用療法、TCZが推奨されました。免疫抑制薬未使用例に対してはMMF、RTX、CYC、早期で炎症マーカーの上昇がある症例に対してはTCZ、皮膚硬化などに対してすでにMMFを使用している場合はオフェブとの2剤併用療法が提案されました(表2)17)。
表2 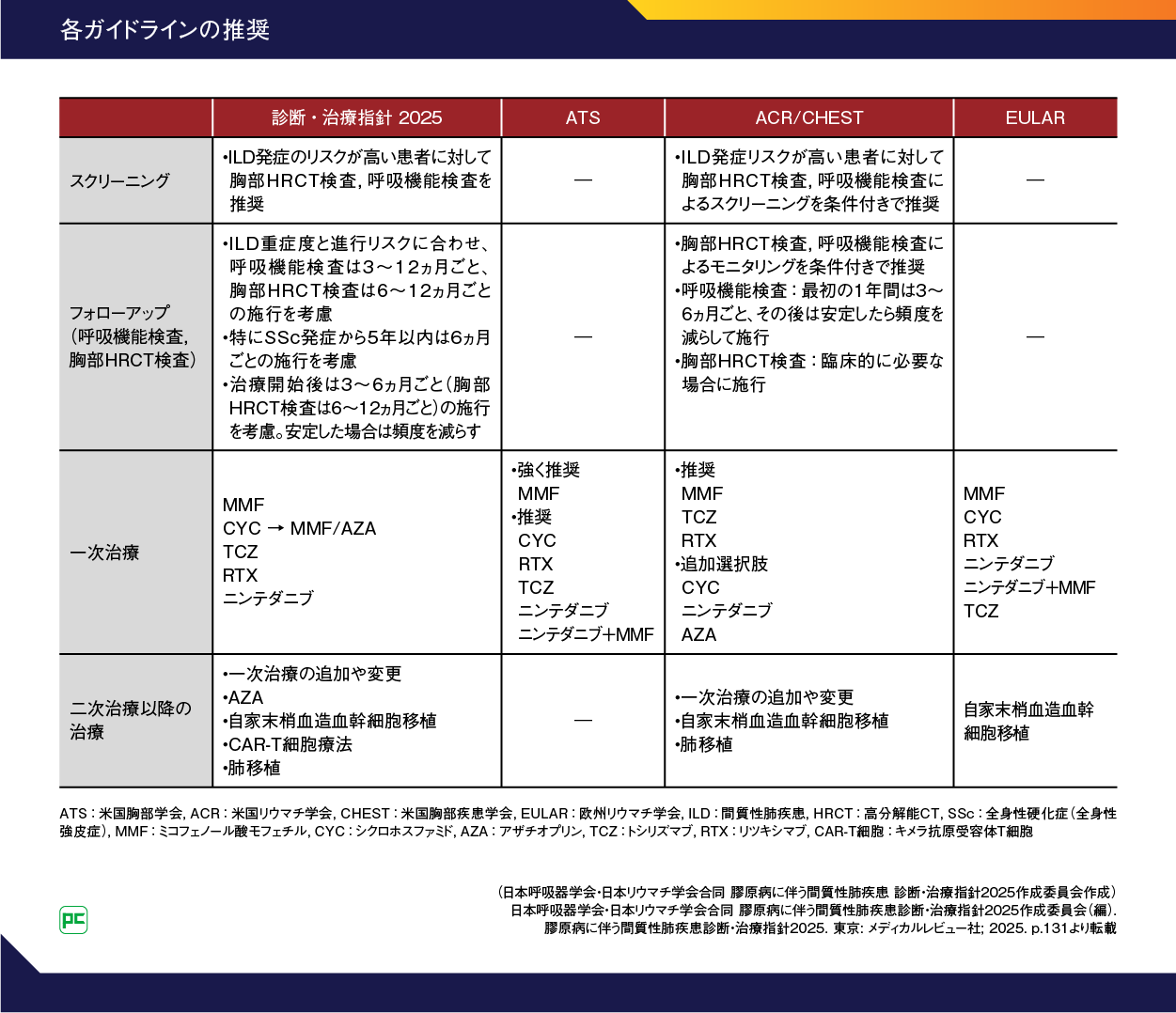
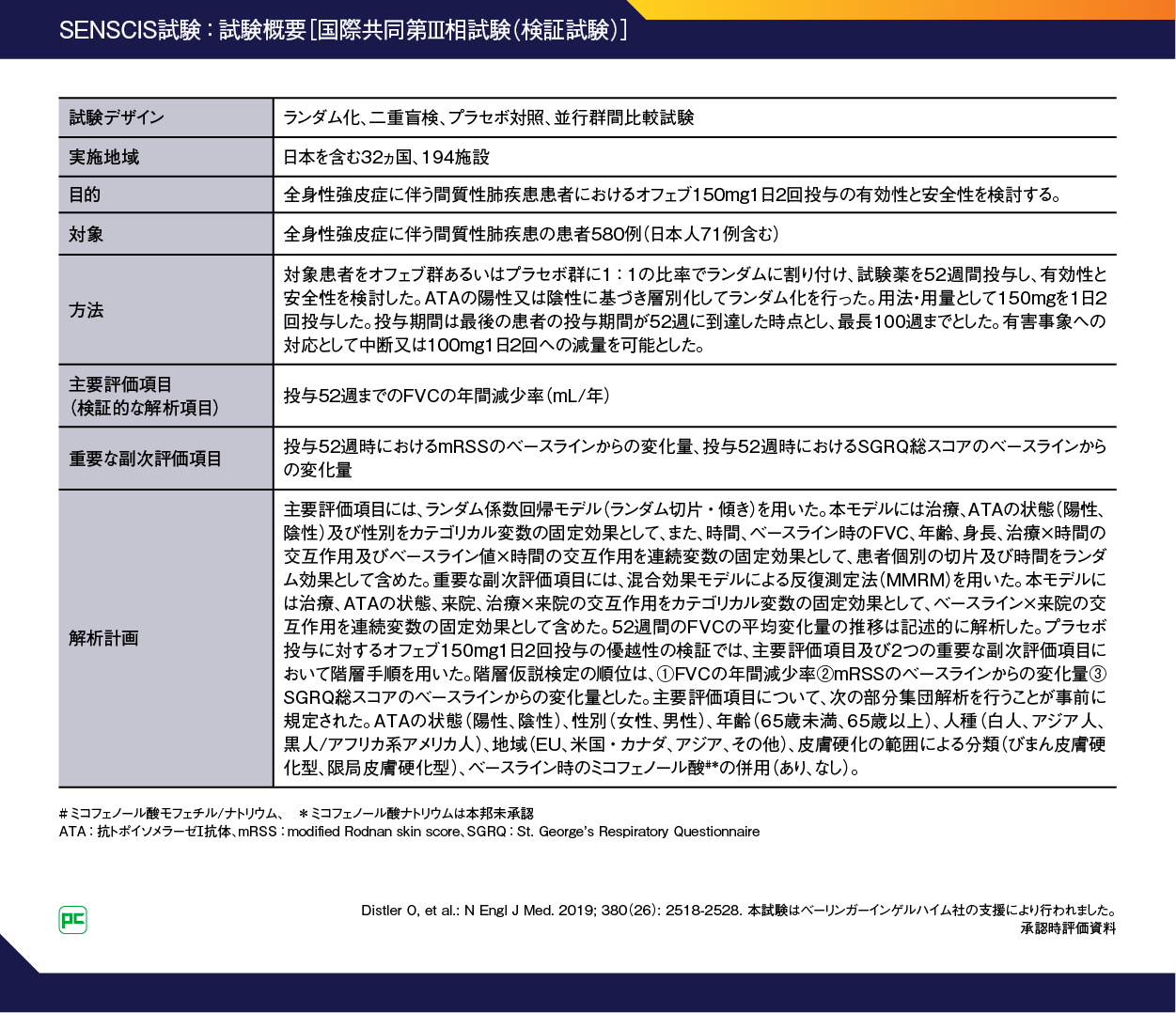
国際共同第Ⅲ相試験SENSCIS試験
試験概要
全身性強皮症に伴う間質性肺疾患(SSc-ILD)におけるオフェブの有効性と安全性を検討した国際共同第Ⅲ相試験(SENSCIS試験)の試験概要です(図5)。
図5
オフェブの呼吸機能低下抑制効果
投与52週までのFVCの年間減少率(ランダム係数回帰モデル)は、オフェブ群-52.4mL/年、プラセボ群-93.3mL/年であり、オフェブ群は、プラセボ群に対してFVCの年間減少率の低下を統計学的に有意に抑制しました(群間差:41.0mL/年、95%CI: 2.9‒79.0、p=0.04)(検証的な解析結果)(図6)。
図6 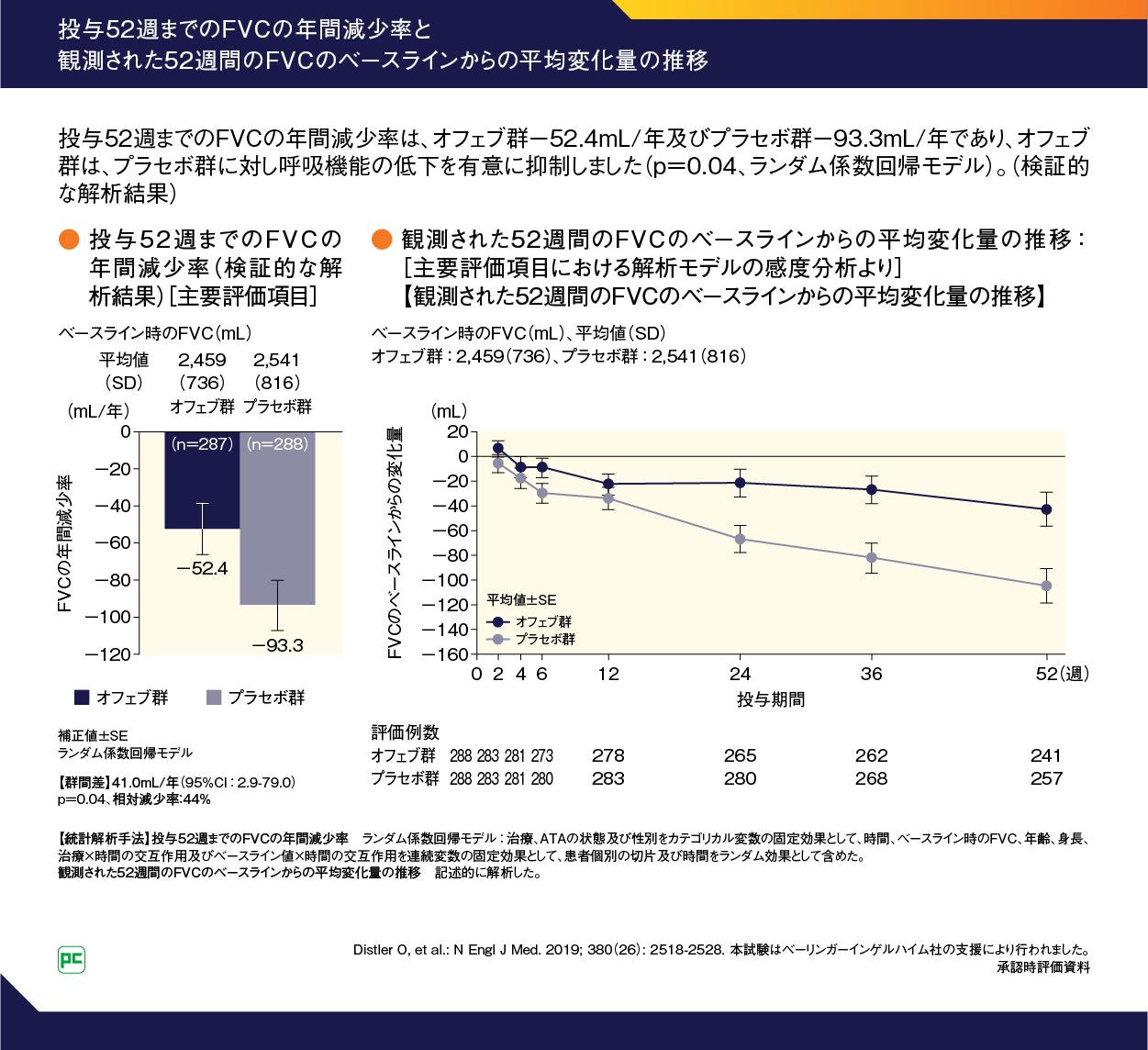
MMFとオフェブの併用(部分集団解析)
MMFとオフェブの併用については、SENSCIS試験では投与52週までのFVCの年間減少率に関してMMF併用の有無で層別化した部分集団解析が実施されました(図7)18)。
図7 
ベースライン時にMMFを併用していた部分集団におけるFVCの年間減少率は、オフェブ群で-40.2mL/年、プラセボ群では-66.5mL/年でした。一方、ベースライン時にMMFを併用していなかった部分集団におけるFVCの年間減少率は、オフェブ群で-63.9mL/年、プラセボ群では-119.3mL/年でした(図8)。
図8 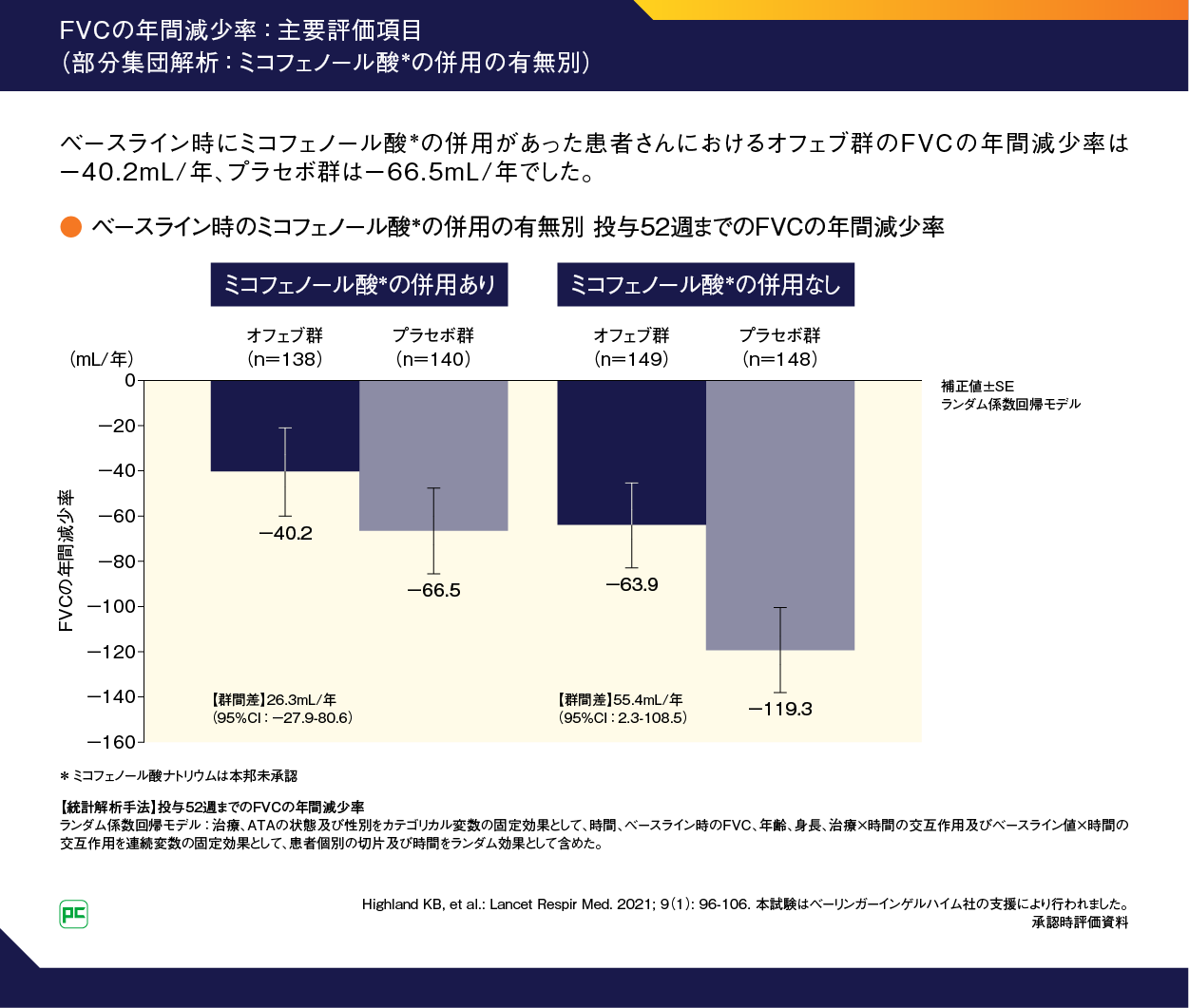
安全性
全期間※における有害事象は、オフェブ群288例中283例(98.3%)、プラセボ群288例中281例(97.6%)に認められました。
※最後の患者の投与期間が52週に到達した時点、最長100週までの試験期間
オフェブ群における投与中止に至った有害事象は50例に認められました。主なものは、下痢22例、悪心6例、嘔吐4例でした。重篤な有害事象はオフェブ群88例に認められ、主なもの(発現率1%以上)は間質性肺疾患、肺炎が各10例(3.5%)、呼吸困難、肺高血圧症が各5例(1.7%)、肺動脈性肺高血圧症、肺線維症が各4例(1.4%)、全身性硬化症肺、急性腎障害、気道感染、卵巣嚢胞が各3例(1.0%)でした。死亡に至った有害事象はオフェブ群6例に認められ、内訳は肺腺癌、血栓性微小血管症・強皮症腎クリーゼ、不整脈、肺炎、急性肺損傷、悪性中皮腫が各1例でした。このうち1例(急性肺損傷)は試験薬との因果関係が否定されませんでした。
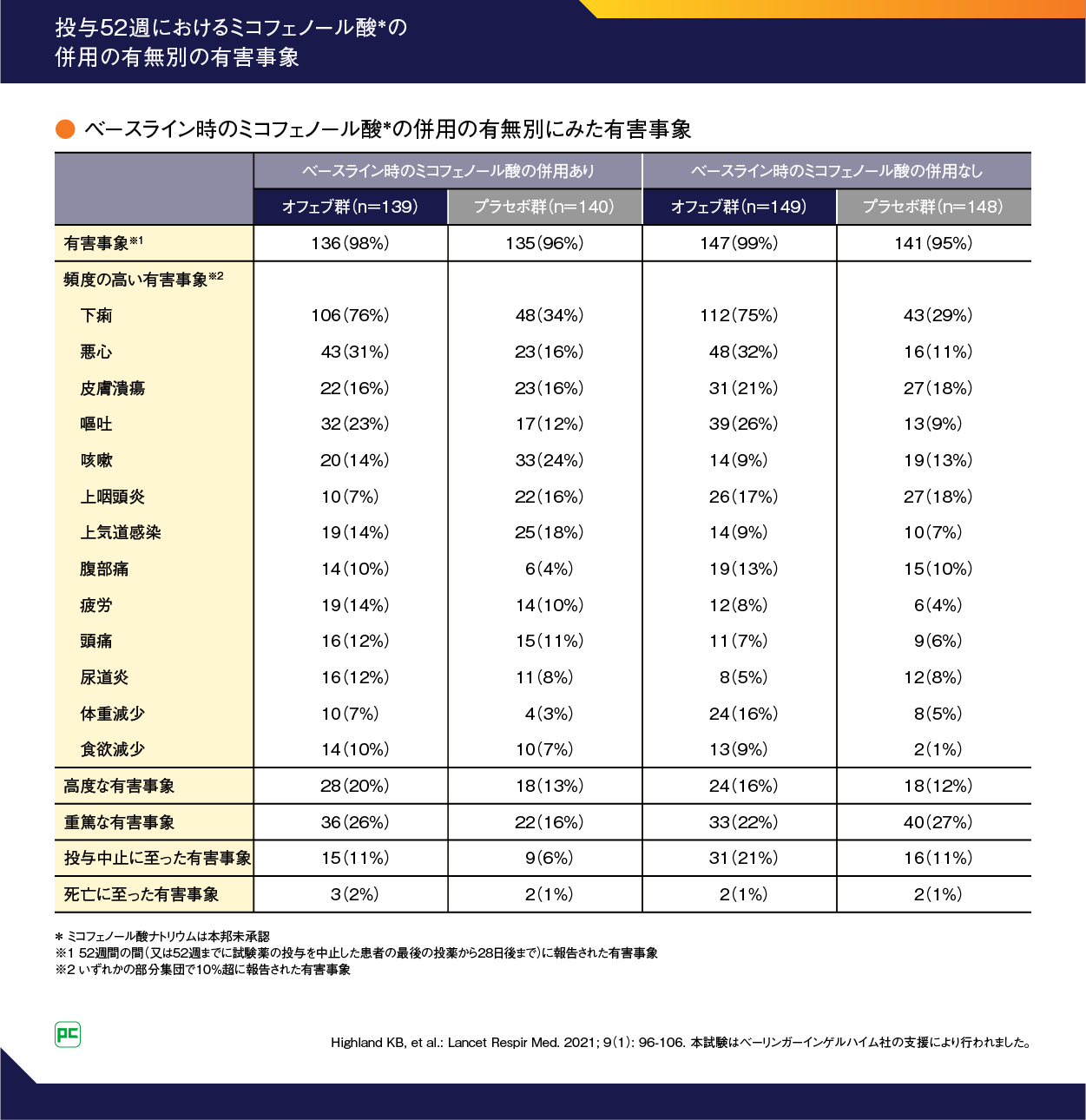
SENSCIS試験の安全性(表3、表4)、MMFの併用の有無別の有害事象(表5)は以下の通りです。
表3

表4

表5
まとめ
SSc-ILDでは、Extensive diseaseで高度呼吸機能低下がない場合には、治療薬による介入の対象となります。また、診断時にLimited diseaseで低リスクに分類された患者さんであっても、定期的なモニタリングで進行が認められれば治療介入を検討する必要があります。
今回のCTD-ILD診断・治療指針改訂で追加された複数のILD進展予測因子をどのように組み合わせて高リスク・低リスクを判断するかなどは今後の課題でしょう。予後不良因子を複数持つSSc患者さんでは、治療介入の必要性を総合的に検討するとともに、従来からの6分間歩行テストや呼吸器機能検査など、ILD進展の予測因子を引き続き評価していくことも重要と考えられます。
今回ご紹介した内容をSSc-ILD患者さんのご診療にお役立てていただけますと幸いです。
その他の関連情報


特発性肺線維症および進行性肺線維症 国際診療ガイドライン2022(静止画)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



