
関節リウマチに伴う間質性肺疾患(RA-ILD)に対する治療戦略 ~膠原病に伴う間質性肺疾患 診断・治療指針2025より~ (静止画)
サイトへ公開:2025年07月30日 (水)
クイックリンク

2025年4月、日本呼吸器学会・日本リウマチ学会の共同編集による「膠原病に伴う間質性肺疾患 診断・治療指針 2025」(以下、CTD-ILD診断・治療指針2025年版)が発刊されました1)。このCTD-ILD診断・治療指針2025年版では、新たに関節リウマチに伴う間質性肺疾患(RA-ILD)の治療アルゴリズム(案)が新たに提案されました。
今回は、CTD-ILD診断・治療指針2025年版で提案されたRA-ILDの治療アルゴリズム(案)を中心に、RAに合併するILDの診断・治療介入の重要性について解説します。
RAおよび進行性線維化を伴うRA-ILDの推定患者数とILD診療の重要性
進行性線維化を伴うRA-ILDの推定患者数
関節リウマチ(RA)は、多発関節炎を特徴とする全身性炎症性自己免疫疾患です。厚生労働省のナショナルデータベース(レセプト情報・特定健診等情報データベース)を用いた解析では、日本の関節リウマチ(RA)患者数は82.57万人(女性は76.3%)と算出されています2)。
わが国のRAの主な死因は、悪性腫瘍(24.2%)と並び呼吸器疾患(24.2%)が多く、そのなかで肺炎(12.1%)に次いでILD(11.1%)の占める割合が高くなっています(IORRA研究)3)。つまり、RA患者さんにとって、ILDは予後に直接関連する重要な因子であるといえます1)。
それでは、わが国において、RA患者さんのうちどのくらいの割合でILDを発症し、また発症したRA-ILDのうちどのくらいの割合が進行性線維化を伴う間質性肺疾患(PF-ILD)に進展するのでしょうか。
RA患者数約82.6万人のうち、海外のILD有病率のデータから推算すると約11%にあたる9万人程度がILDを発症すると予想されます2, 4)。さらに、日本を含む7ヵ国の呼吸器専門医、リウマチ専門医、内科医を対象としたアンケート調査の2019年の報告では、RA-ILD患者さんのうち26%がPF-ILDに進展すると推定されています5)(図1)。
図1 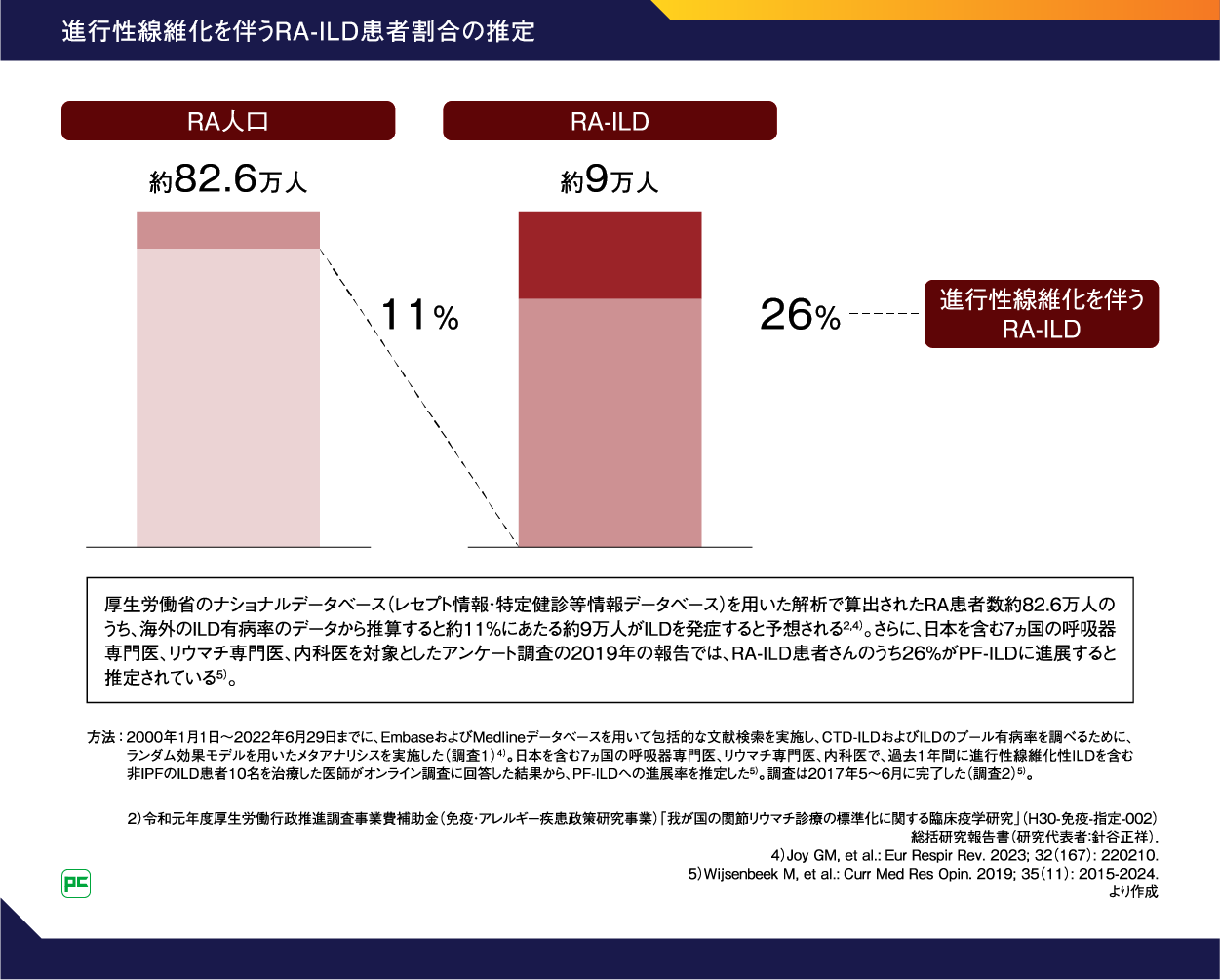
RA-ILDにおける予後不良予測
RA-ILDの予後不良因子の一つに、RAの高疾患活動性があります1)。ILD発症に対するRAの疾患活動性の影響を前向きに検証した研究では、中等度/高疾患活動性群は、寛解/低疾患活動性群と比較して、RA-ILD発症の多変量ハザード比(HR) は2.22(95%CI 1.28-3.82)(図2)でした。RAの疾患活動性の悪化がILD発症のリスクを上昇させることが報告されています6)。
図2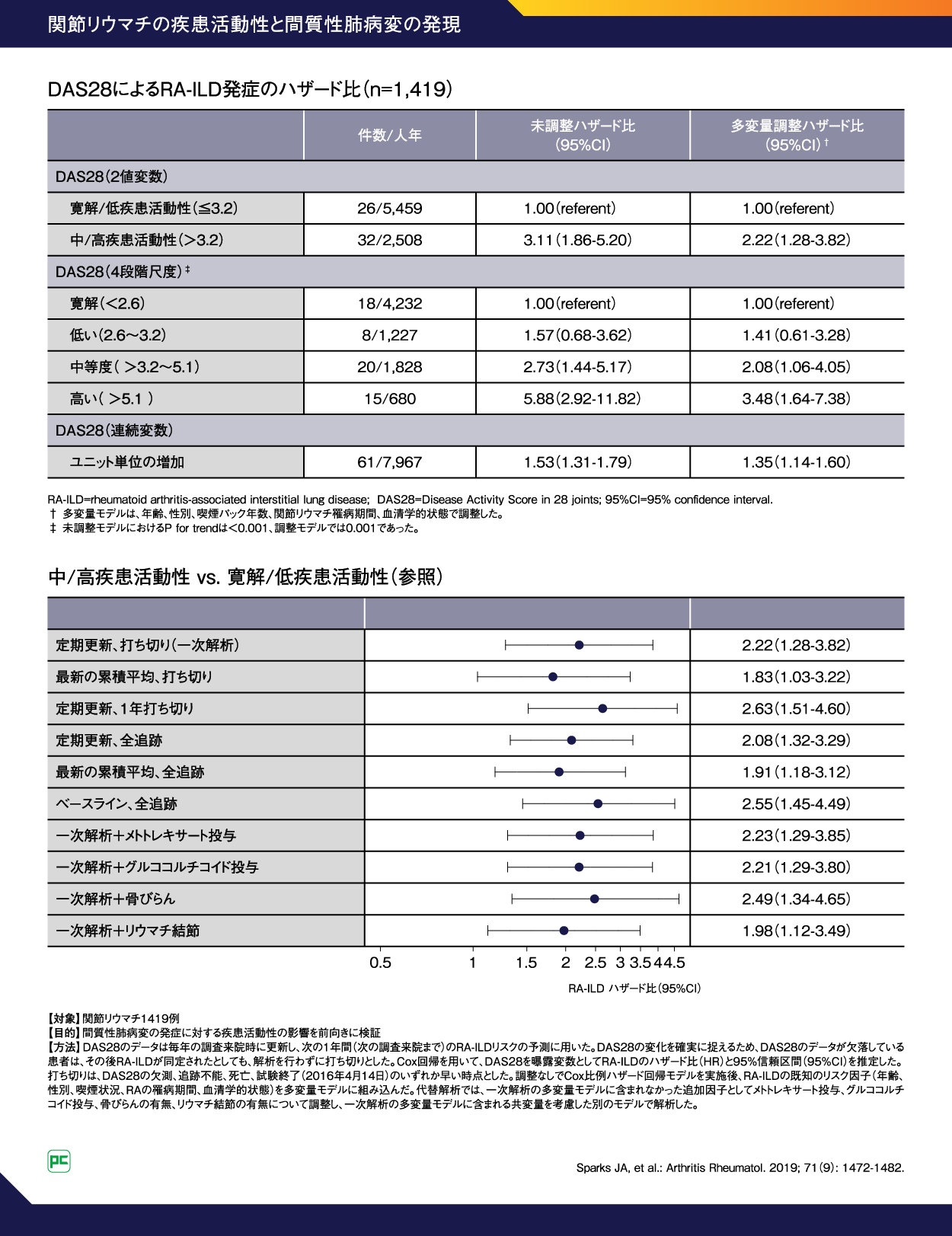
また、RAの疾患活動性とILDの重症度が死亡率に及ぼす複合的な影響を評価した研究では、RAの疾患活動性(HR 3.00; 95%CI: 1.13-7.97)または%FVCの低下(HR 3.07; 95%CI: 1.03-9.19) のいずれかの存在が、生存率の低下と有意に関連していたことがわかりました(図3)7)。RAの疾患活動性が高い、または%FVCの低下があるRA-ILD患者は死亡リスクが3倍以上高く、両方がある患者では4倍以上(HR 4.43; 95%CI: 1.70-11.55)高い結果となりました7)。原疾患の疾患活動性、身体機能やQOL、呼吸機能の重症度が生存に独立して影響していることを踏まえ、全身性疾患であるRA-ILD患者を包括的にモニタリングおよび治療することの重要性が示されたといえます7)。
図3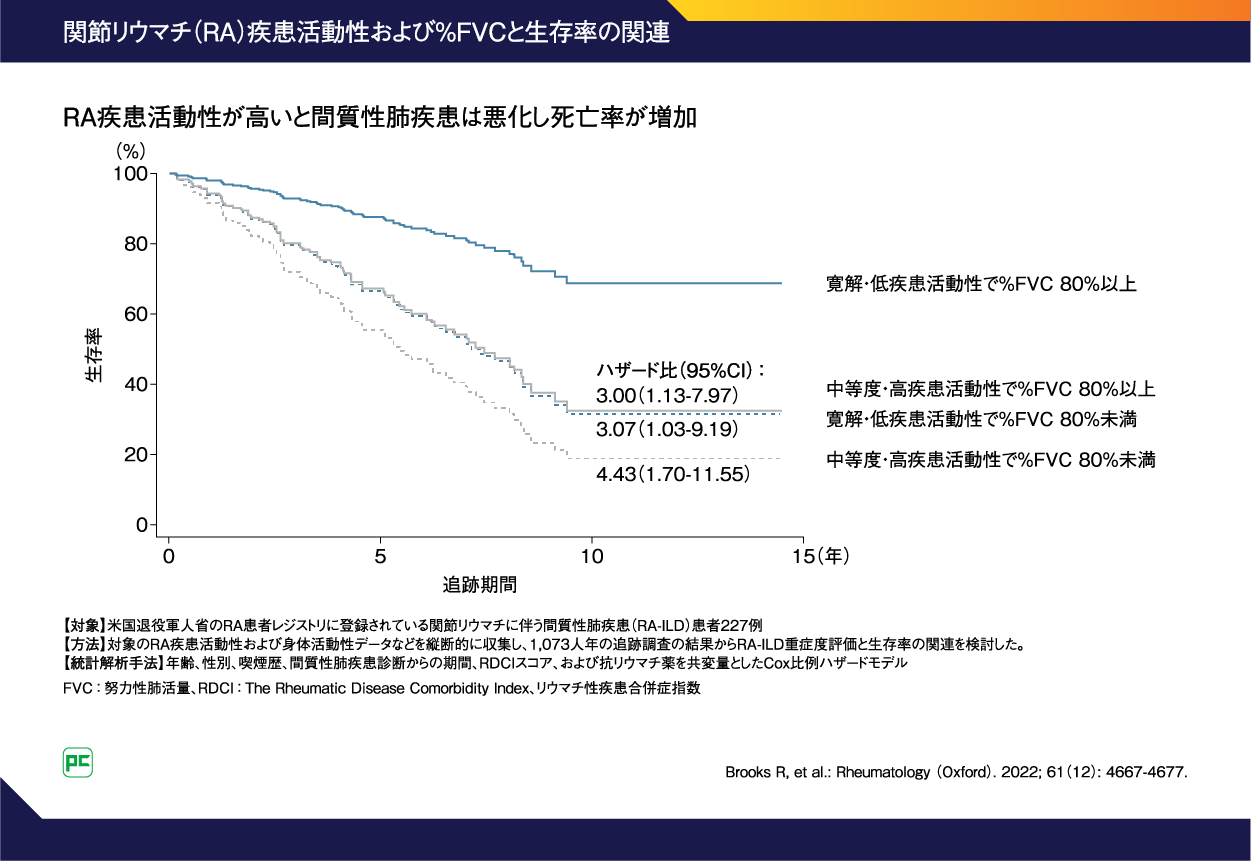
また、SSc-ILD の重症度評価および病期分類に用いられるGoh分類をRA-ILD用に改変した修正SSc-ILD分類による転帰予測とUIPパターンの有無に基づく各群の生存率を検討した研究では、図48, 9)に示すとおり、Bad outcome+definite UIP群の3年生存率は35%、6年生存率は35%という結果でした8)。多変量モデルによる解析では、修正SSc-ILD分類でBad outcome群に分類されたRA-ILD患者とIPF患者の間で、転帰の差は認められなかったと報告されています8)。HRCTでの病変の広がりやFVCの低下、UIPパターンである場合はIPFと同様に予後が悪いため、早期の治療介入が重要となります。
図4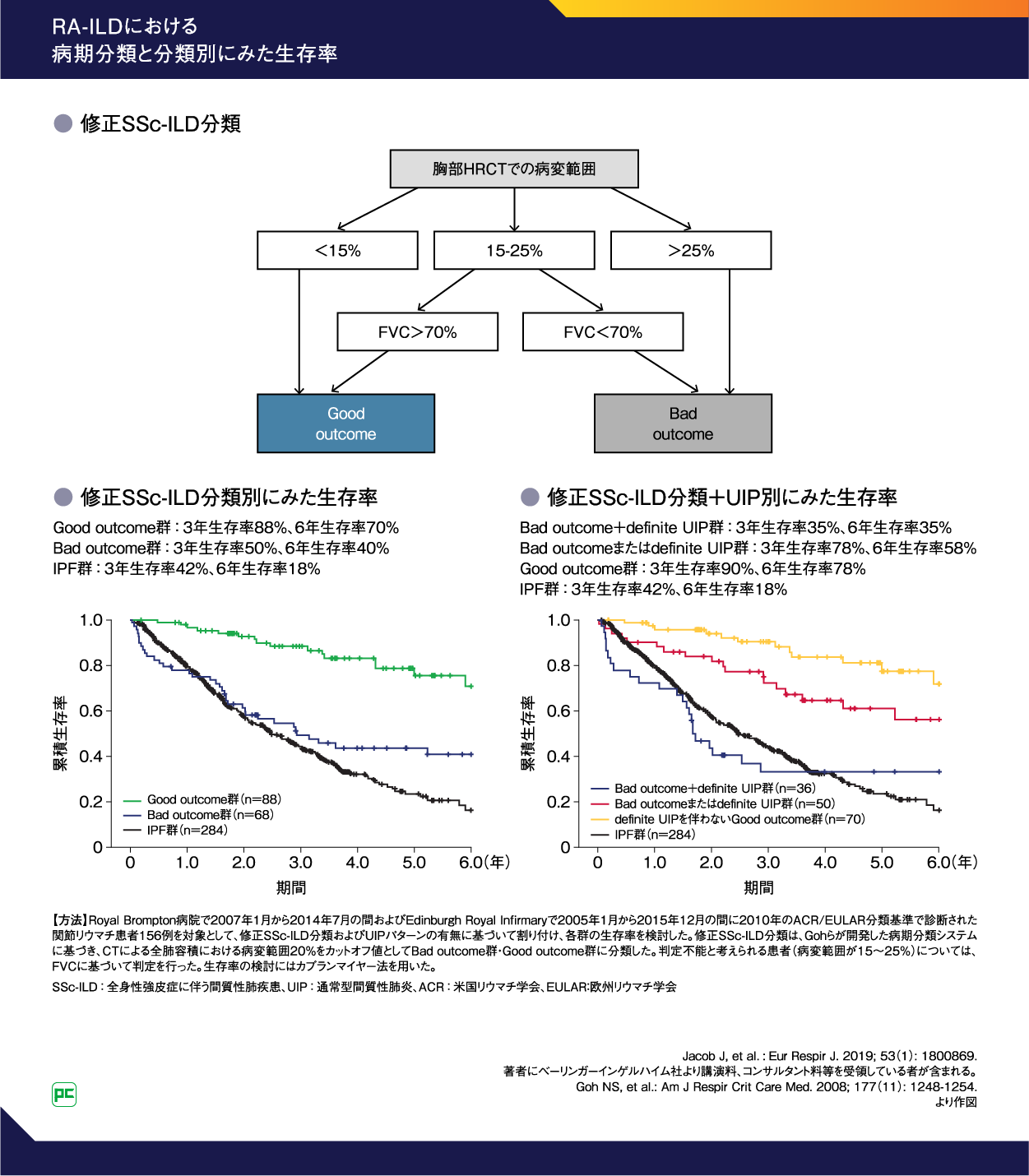
CTD-ILD診断・治療指針2025年版におけるRA -ILDの治療アルゴリズム
CTD-ILD診断・治療指針2025年版の治療アルゴリズム(案)(図5)1)では、まずILDの発症様式が「急性・亜急性」か「慢性」かによって区別します。
RA-ILDの治療においては、RAによる関節炎自体の活動性とILDの進行性および重症度の両者の評価が必須であるとされています1)。その理由として、RAの高疾患活動性が予後不良因子であるばかりでなく、ILD進行のリスク因子である報告もあることから、どちらかだけに重きを置いた治療では不良の転帰をたどる可能性があることが挙げられます1, 10)。そのため、まずはRAの臨床的寛解、低疾患活動性の達成を目指すべきであるとされています1, 11)。
図5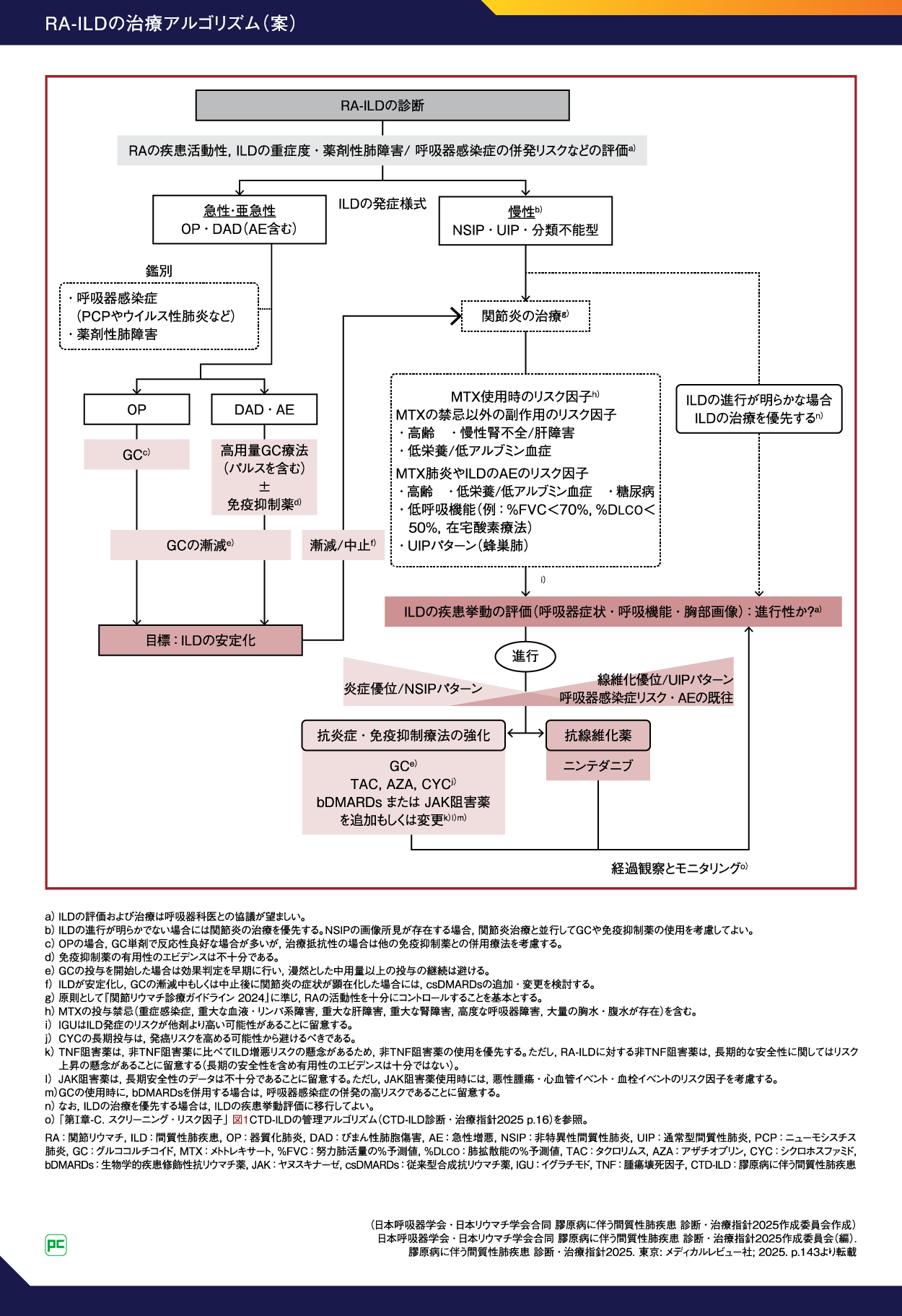
ILD慢性でILDの進行が明らかでない場合
関節炎の治療を優先します(図5)1)。
ILD慢性でILDの進行が明らかな場合
ILDによる症状の増悪や胸部画像の進行が明らかな場合にはILDの治療が優先され、治療介入を検討するために、呼吸器症状や呼吸機能・胸部画像などの疾患挙動を確認します(図5)1)。ILDの評価および治療方針の決定については、膠原病・リウマチ科医と呼吸器科医の合議のうえで行うことが推奨されています1)。
ILDの疾患挙動の評価
ILD の疾患挙動の評価は、①呼吸器症状の悪化、②FVCなどの呼吸機能の低下、③胸部画像検査による線維化の広がりといったPPFもしくはPF-ILDに準じて行います。
①呼吸器症状
ILDでは、特徴的な症状として痰を伴わない空咳や労作時の息切れがみられますが、早期の段階では、自覚症状に乏しいことが多いと考えられます。そのため、呼吸器症状の聴き取りに、患者さんへの質問票を活用することも重要です。CTD-ILD診断・治療指針2025年版では、CTD-ILDで使用されている患者報告型アウトカム尺度(PROMs)として、さまざまな呼吸困難スケールが示されています(表1)1, 12-44)。
表1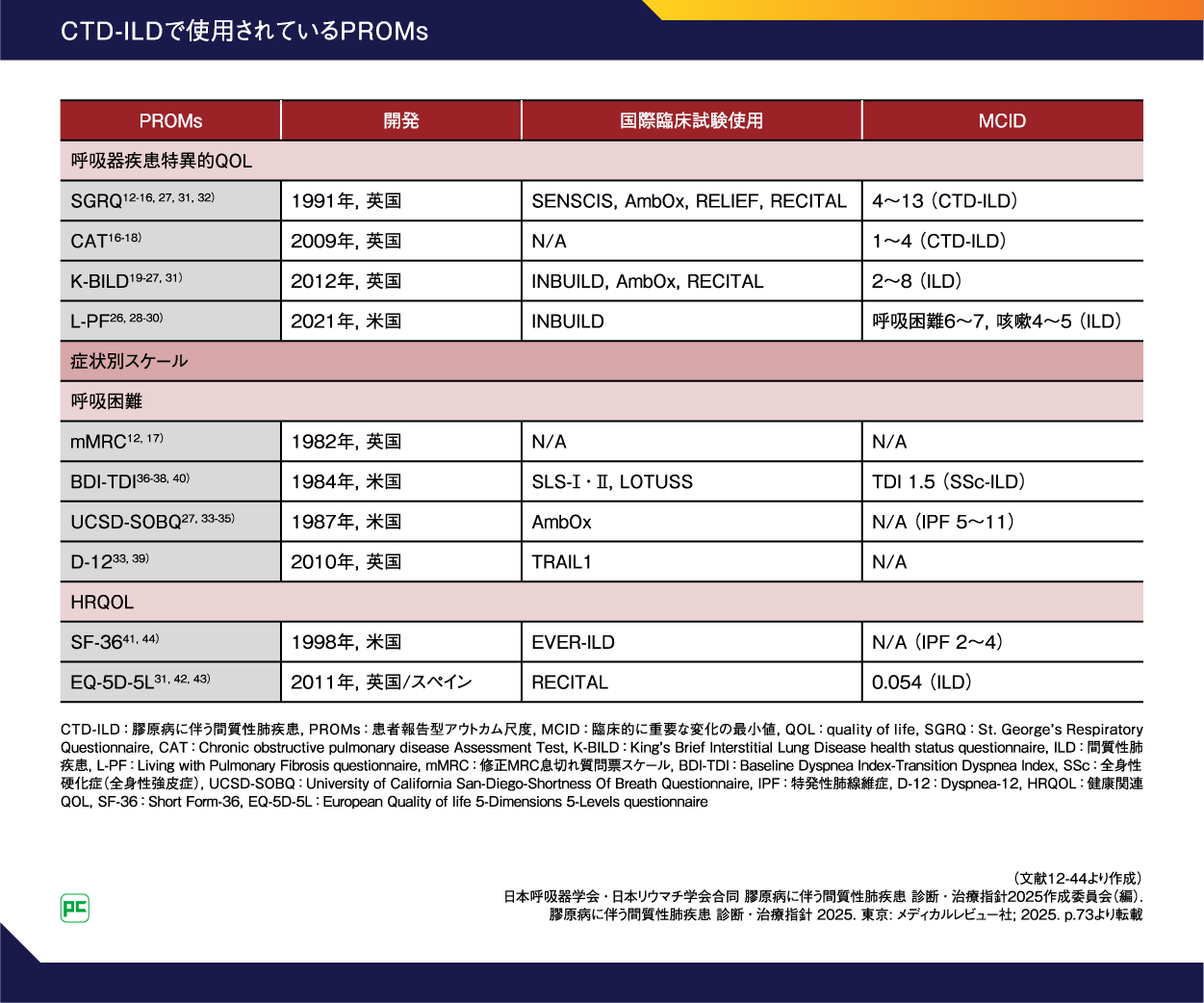
呼吸困難スケールの代表的な指標としては、修正MRC息切れ質問票スケール(mMRC)があります(図6)45-47)。mMRCは、日常生活に対する呼吸困難(息切れ)の影響をグレード0から4までの5段階で測定する質問票で、ILDに限らず、息切れの程度を評価する簡便な方法としてよく用いられています47)。
図6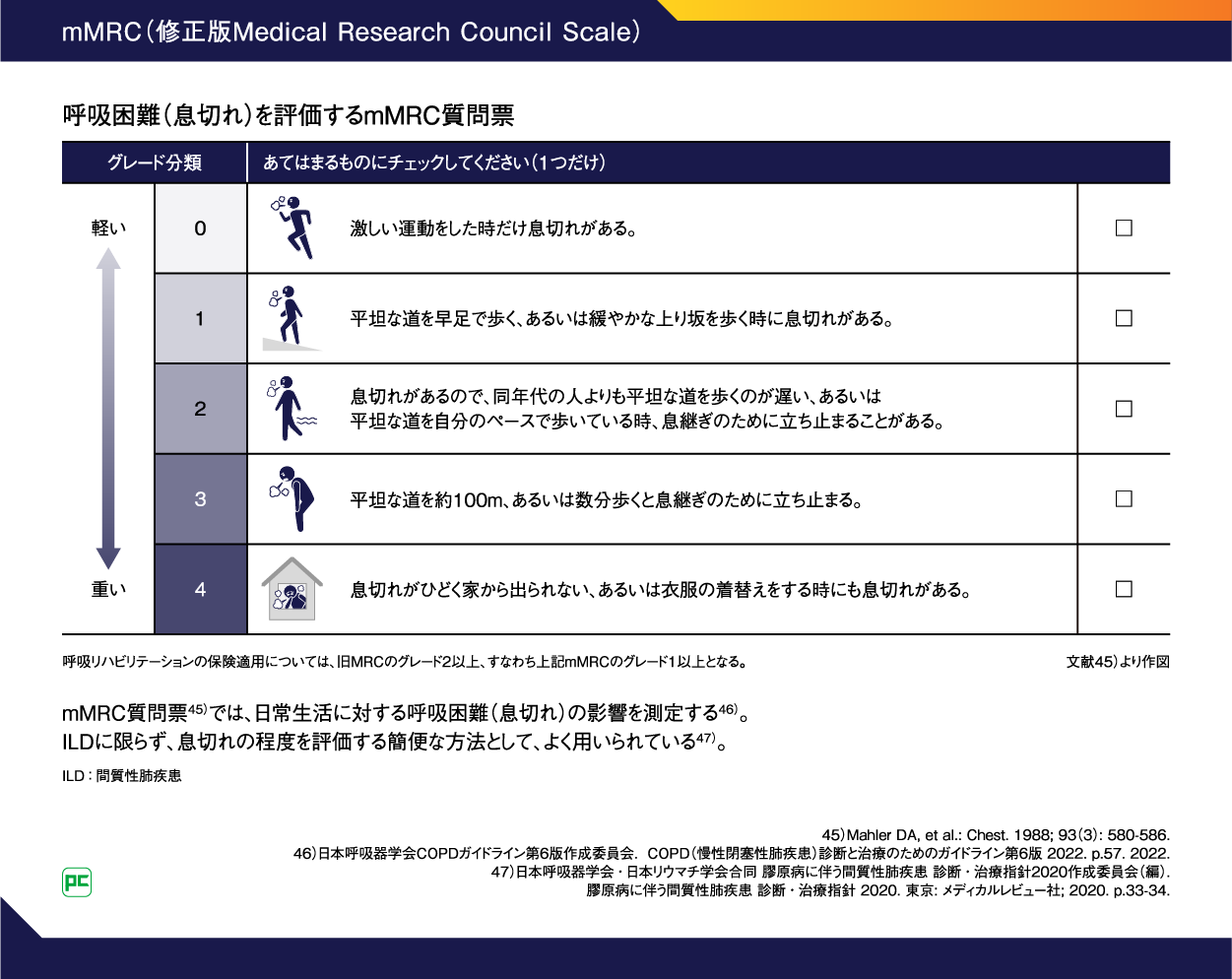
②呼吸機能
ILDの重症度や進行を捉えるために最も使用されているのが呼吸機能検査です。FVC とDLCO が主に用いられます。RA-ILDでは初回評価時のFVCやDLCOが低値である場合、予後不良であることが知られており、治療介入の指標とされています1, 48-49)。
③胸部画像検査
RA-ILD の画像所見は、米国胸部学会(ATS)/ 欧州呼吸器学会(ERS)による特発性間質性肺炎(IIPs)のパターン分類に準拠して分類されています1)。
胸部HRCT検査による解析では、下肺野・背側・胸膜直下優位の網状影、牽引性気管支・細気管支拡張症や蜂巣肺が主体のUIPパターン(図7-A)と、中・下肺野優位で気管支血管束周囲や末梢側の不規則・斑状のすりガラス影や浸潤影、牽引性気管支拡張、容積減少を呈する非特異性間質性肺炎(NSIP)パターン(図7-B)の2つのパターンが大部分を占めますが、以下のように多彩な画像所見が認められるうえ、胸部HRCTによる分類が困難な症例も一定の頻度で存在します1)。
UIPパターン:24~79%
NSIPパターン:17~40%
蜂巣肺:約16%
OPパターン(図7-C):約5%
DADパターン:まれながらあり
胸部HRCTによる分類困難:6~52%
図7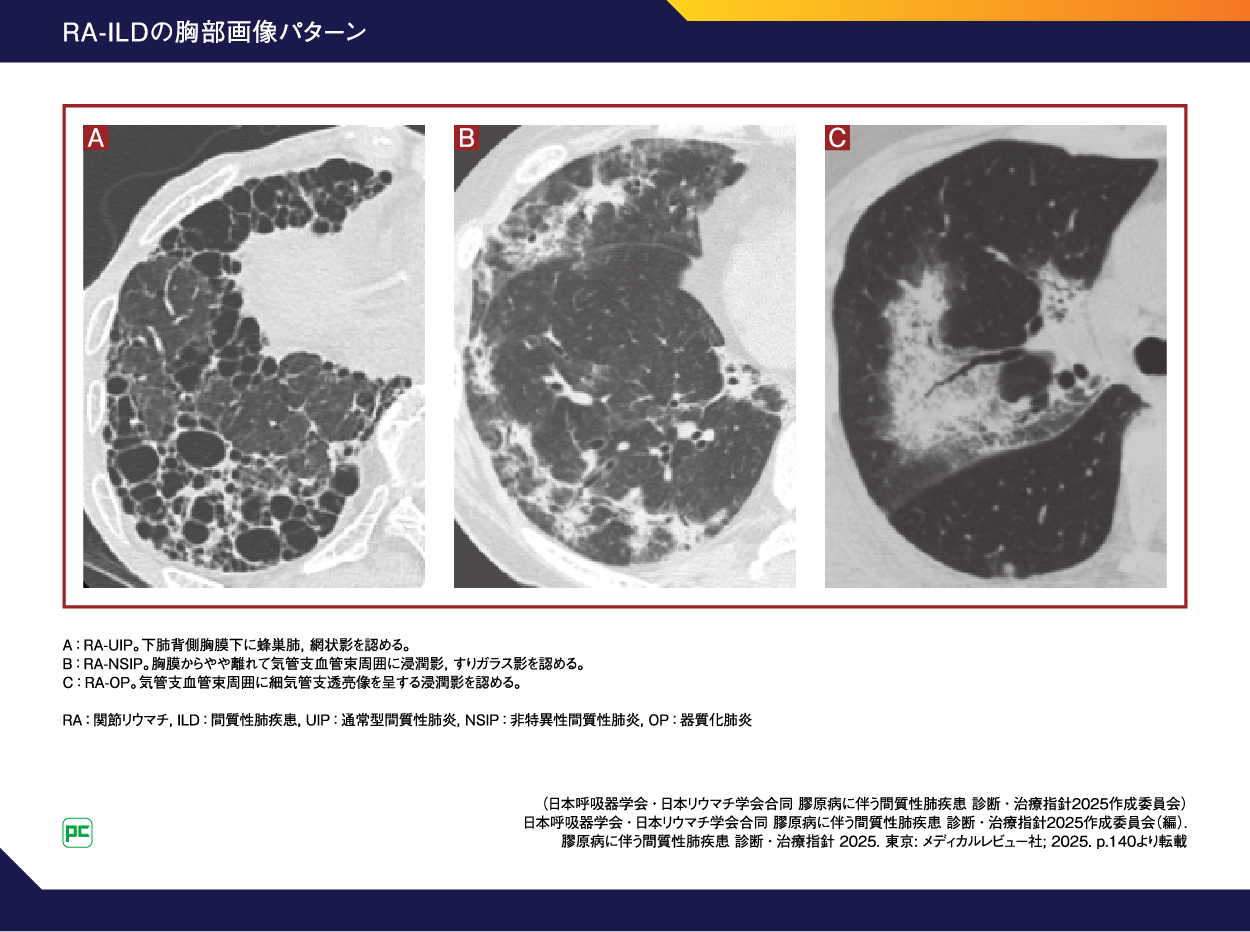
RA-ILDは多彩な病理像を呈するため、UIPパターンかNSIPパターンかの胸部HRCTによるパターン分類が困難な症例が多いことにも注意が必要です1, 50, 51)。暫定的にUIPパターンやNSIPパターンと考えた場合や分類不能型とした際においても、3~6ヵ月といった短期間だけではなく年余にわたる長期的な経過をみることで、治療目標が現状維持か、進行性ではあるが病勢の安定化を目指すのか、疾患進行を緩徐にすることなのかを見据えて治療方針を立てることが重要です。
ILDの進行が認められた場合
炎症優位/NSIPか線維化優位/UIPかにより、抗炎症・免疫抑制療法の強化または抗線維化薬ニンテダニブ(オフェブ)の投与を検討します1)。
線維化優位/UIPには、原則として抗炎症・免疫抑制療法は行われませんが、例えば図8のように関節リウマチに伴うUIP(RA-UIP)では、臨床的に抗炎症・免疫抑制療法が行われ、部分的な改善が見られることがあります。これは、CTD-ILDが多様なパターンを呈し、UIPとNSIPを明確に分類しづらいことが影響している可能性があります50)。つまり、純粋なUIP病変には抗炎症・免疫抑制療法は効かないものの、混在した炎症細胞浸潤の部位に部分的な治療効果を示している可能性が考えられています。炎症所見の改善だけでなく線維化を抑制するためには、進行性線維化をターゲットとした治療が必要と考えられます。
図8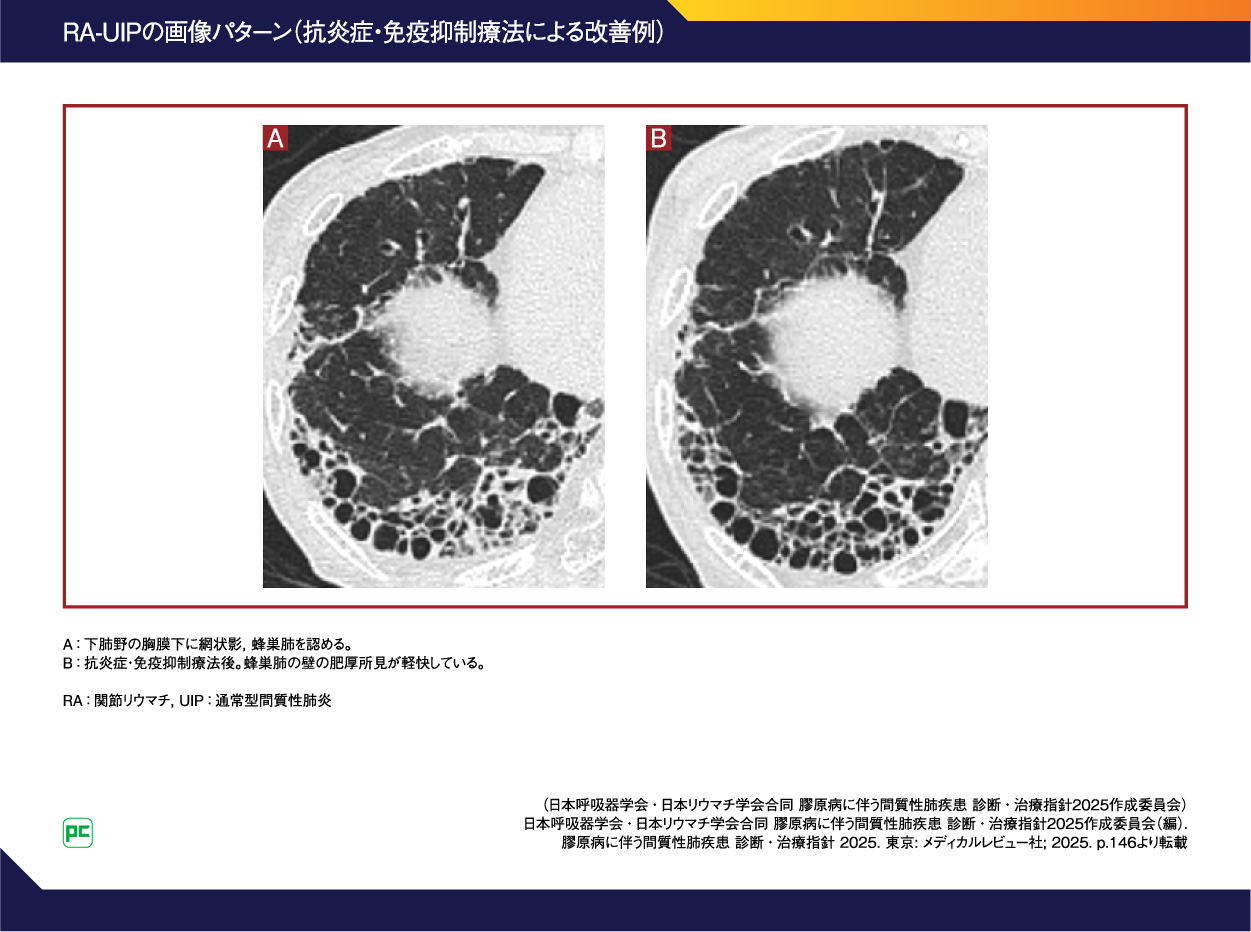
IPF以外のPF-ILDを対象としたINBUILD試験[国際共同第Ⅲ相試験(検証試験)]で、2つのco-primary評価集団において、ニンテダニブ(オフェブ)群は、プラセボ群に対してFVCの年間減少率の低下を統計学的に有意に抑制しました(検証的な解析結果)26)。この試験に組み込まれたRA-ILD患者の大多数はUIP様パターンであったことからも、線維化優位/UIPパターンの場合には、抗線維化薬ニンテダニブ(オフェブ)が選択肢となり得ると考えます52)。
また、RA-NSIPの場合は、IIPs同様、細胞性非特異性間質性肺炎(cNSIP)と線維性非特異性間質性肺炎(fNSIP)に区別して治療を考えることが必要です。RAのfNSIPでは、線維化が慢性進行性の場合が多いため、肺病変以外の全身症状が安定し、肺病変が線維化主体であったり、抗炎症・免疫抑制療法の強化や併用はリスクが高いと判断されたりする場合は、ニンテダニブ(オフェブ)の使用が選択肢となり得ます1)。
ILD の進行を認めた際には、抗炎症・免疫抑制療法の強化をすべきか、抗線維化薬を追加すべきかを慎重に判断する必要があり、特に悩む場合は膠原病・リウマチ科医および呼吸器科医で協議することが望ましいでしょう。
ILDの急性増悪
1ヵ月以内の経過で呼吸困難や呼吸機能の増悪、PaO2 10Torr以上の低下、胸部画像ですりガラス影や浸潤影が新規に出現します(図9)1)。リスク因子としては、高齢、胸部HRCTでUIPパターン、ベースラインのFVCが低値、低アルブミン血症などが挙げられます1)。急性増悪時の呼吸管理については、IPFの急性増悪同様に致死率の高い合併症であるという点からも、侵襲的な挿管・人工呼吸器管理まで実施するかを安定期のうちに患者さんに確認しておくことが望ましいでしょう。また、非侵襲的陽圧換気(NPPV)療法1)や、高流量鼻カニュラ(HFNC)療法1)などの使用も検討してよいと思います。
図9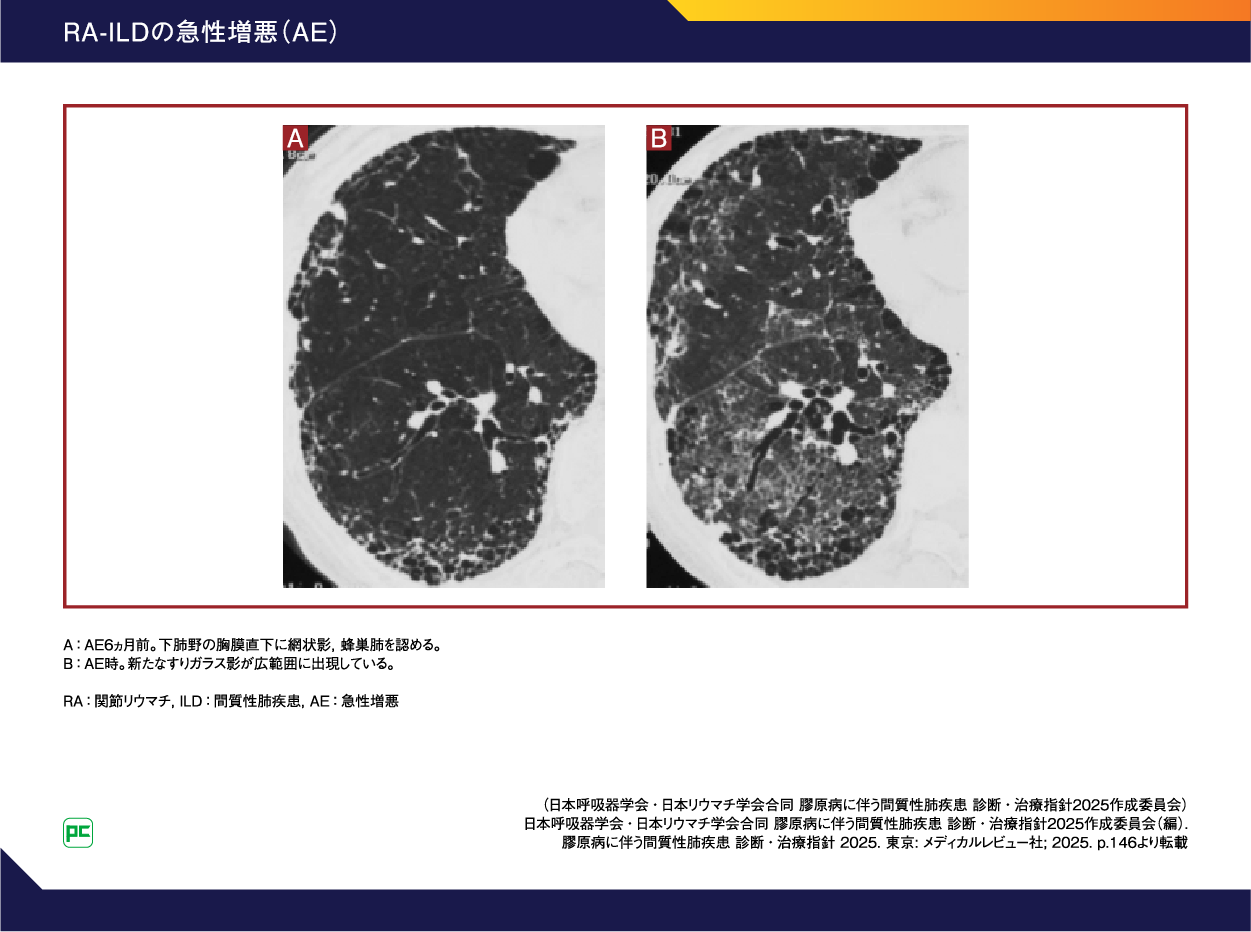
RA-ILDを含むCTD-ILDにおける病態形成および線維化の進展プロセス
図10に示すとおり、CTD-ILDの病態形成および線維化の進展においては、ある時点から炎症と並行するように線維化のプロセスが進行し始めていると考えられます53-58)。
図10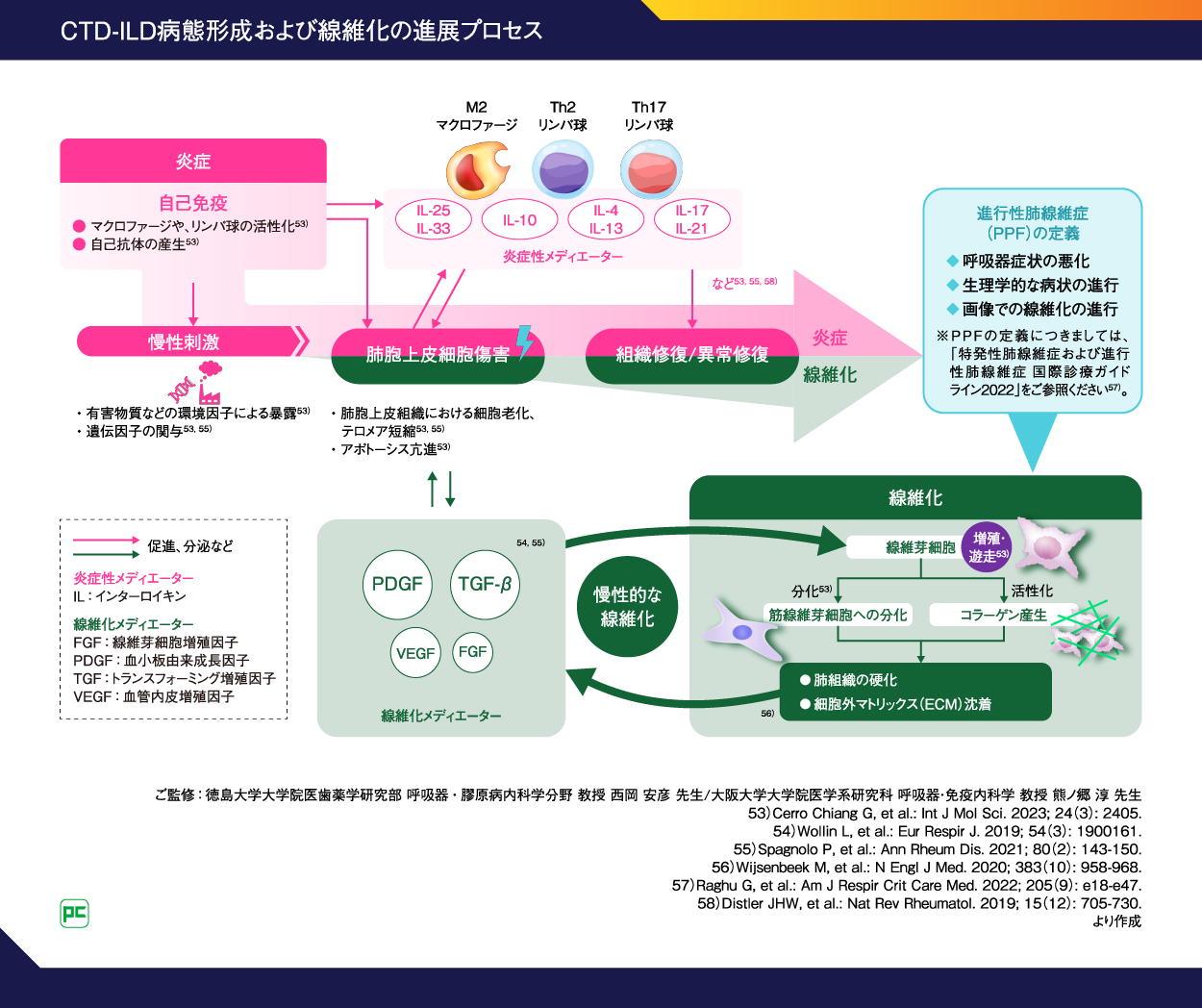
炎症プロセスと線維化プロセスの関係
まず、炎症/自己免疫反応を誘因として肺胞上皮細胞傷害が起こります。このとき、有害物質などの環境因子などの慢性刺激によりさらに炎症が惹起されます53)。自己免疫反応によってマクロファージやリンパ球が活性化され53)、M2マクロファージやTh1およびTh2リンパ球からは炎症性メディエーターが分泌されます53, 58)。炎症性メディエーターが肺胞上皮細胞の炎症を惹起することで、肺胞上皮細胞傷害や組織の異常修復を促進します。
一方、肺胞上皮細胞から分泌された線維化メディエーターは線維芽細胞を刺激し、線維芽細胞の増殖・遊走を引き起こします53)。このことにより、線維芽細胞の活性化によるコラーゲン産生と、線維芽細胞から分化した筋線維芽細胞からのコラーゲンやフィブロネクチンなどの細胞外マトリクス(ECM)タンパク質の産生・沈着53)が促進され、肺組織の硬化による線維化が進行するとされています56)。
各プロセスにおける所見
肺胞上皮細胞傷害に伴う変化としては、労作時呼吸困難、乾性咳嗽、KL-6などの上昇1)がみられます(図11)1, 53-58)。
図11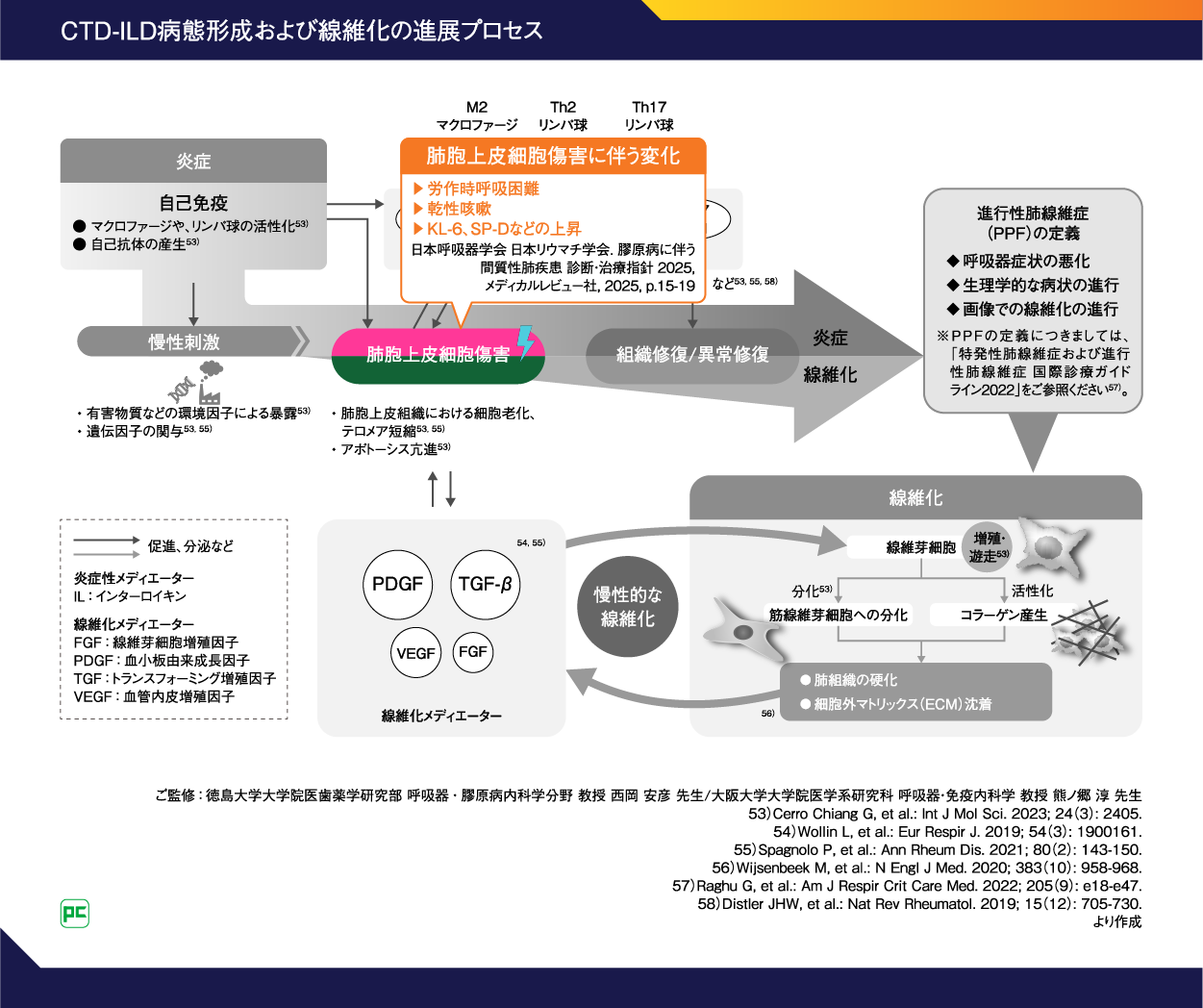
慢性的な線維化に伴う変化としては、FVCやDLCOの低下、胸部HRCT検査による画像所見にてすりガラス影など1)がみられます(図12)1, 53-58)。
図12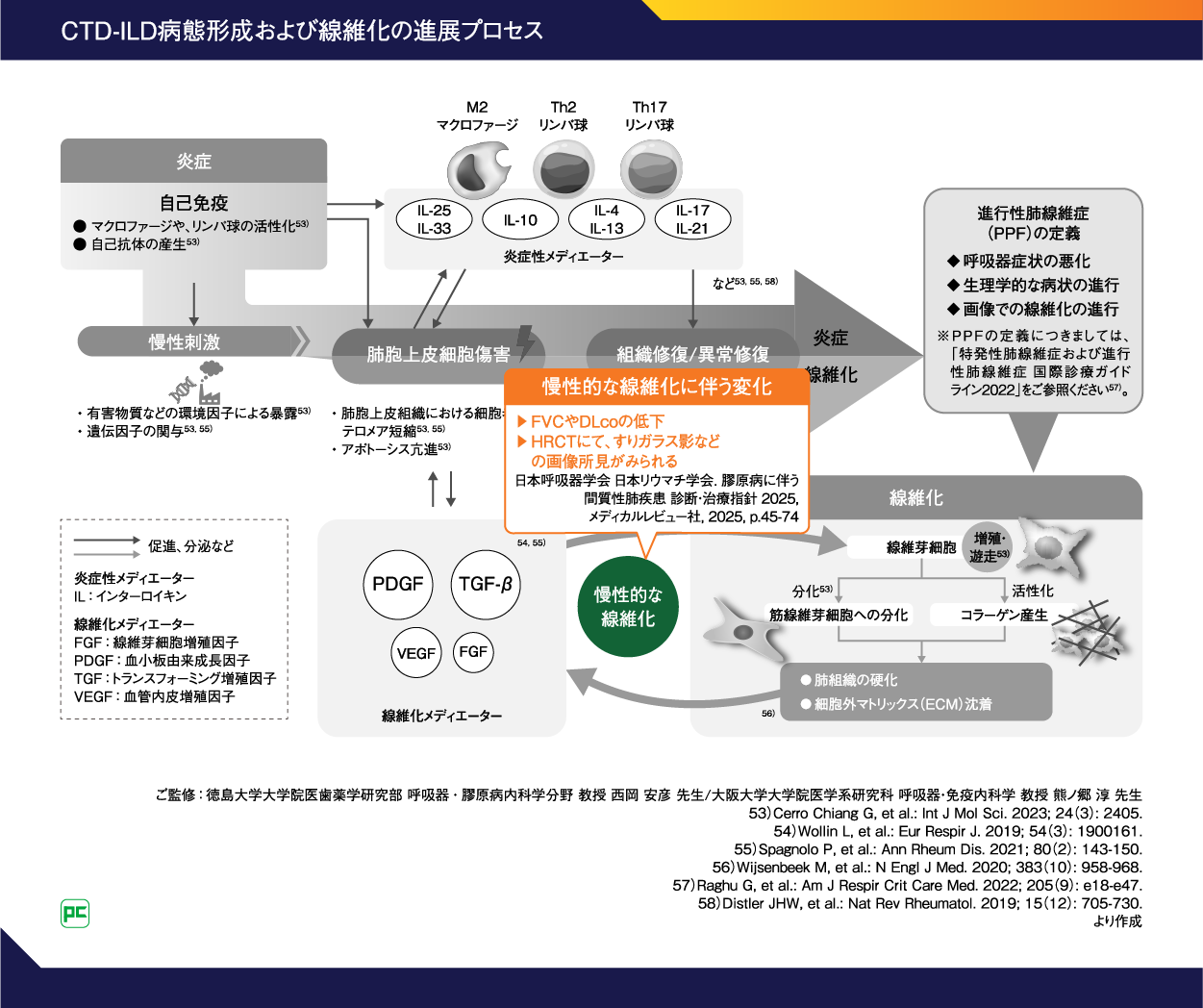
国際共同第Ⅲ相試験 INBUILD試験
試験概要
進行性線維化を伴う間質性肺疾患(PF-ILD)におけるオフェブの有効性と安全性を検討した国際共同第Ⅲ相試験(INBUILD試験)(図13)の試験概要です。
図13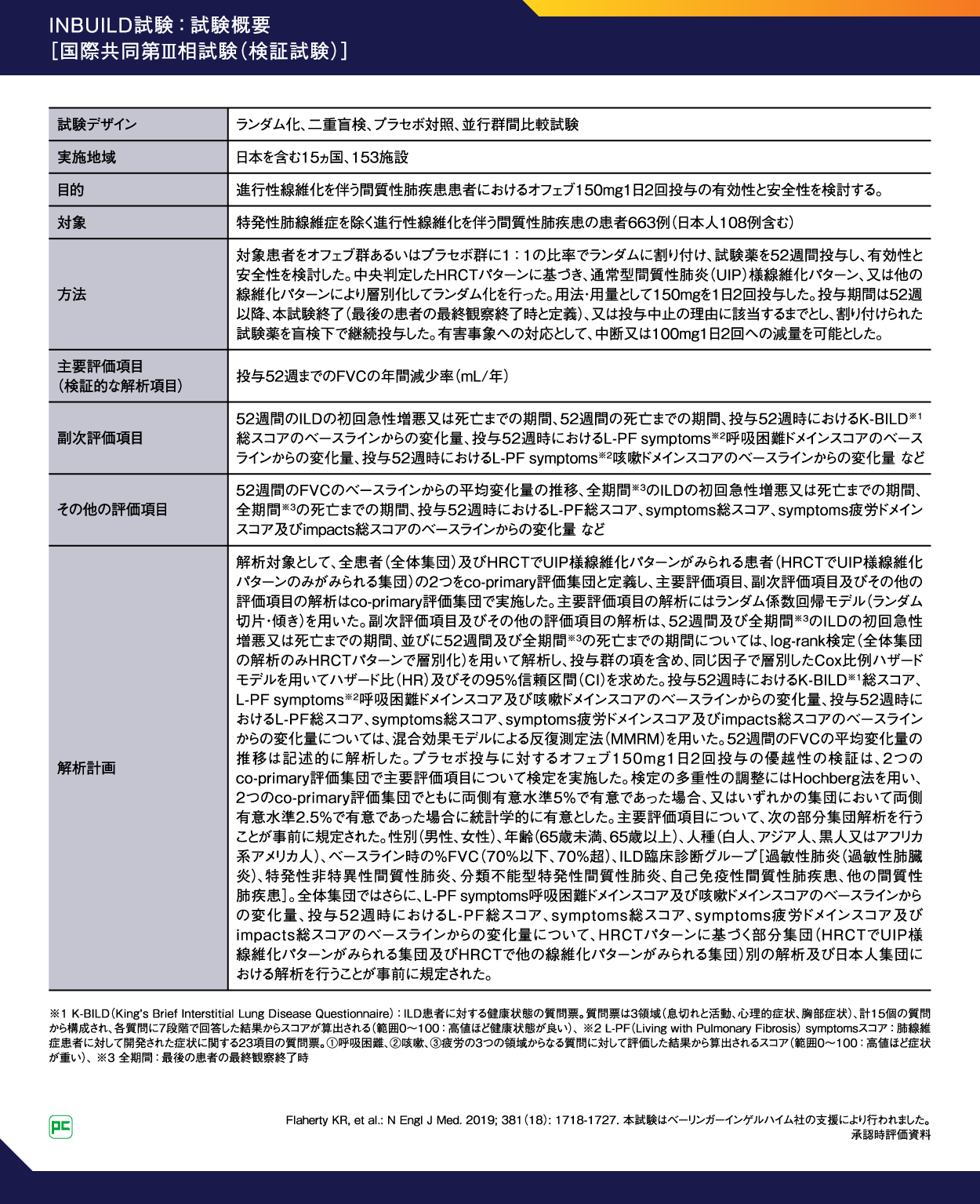
オフェブの呼吸機能低下抑制効果
全体集団における投与52週までのFVCの年間減少率(ランダム係数回帰モデルにより推定)(主要評価項目)は、オフェブ群-80.8mL/年、プラセボ群-187.8mL/年(群間差:107.0mL/年、95%CI:65.4–148.5、p<0.0001)でした(検証的な解析結果)(図14左)。
また、52週までのFVCのベースラインからの変化量は、右側の図のように推移しました(図14右)。
図14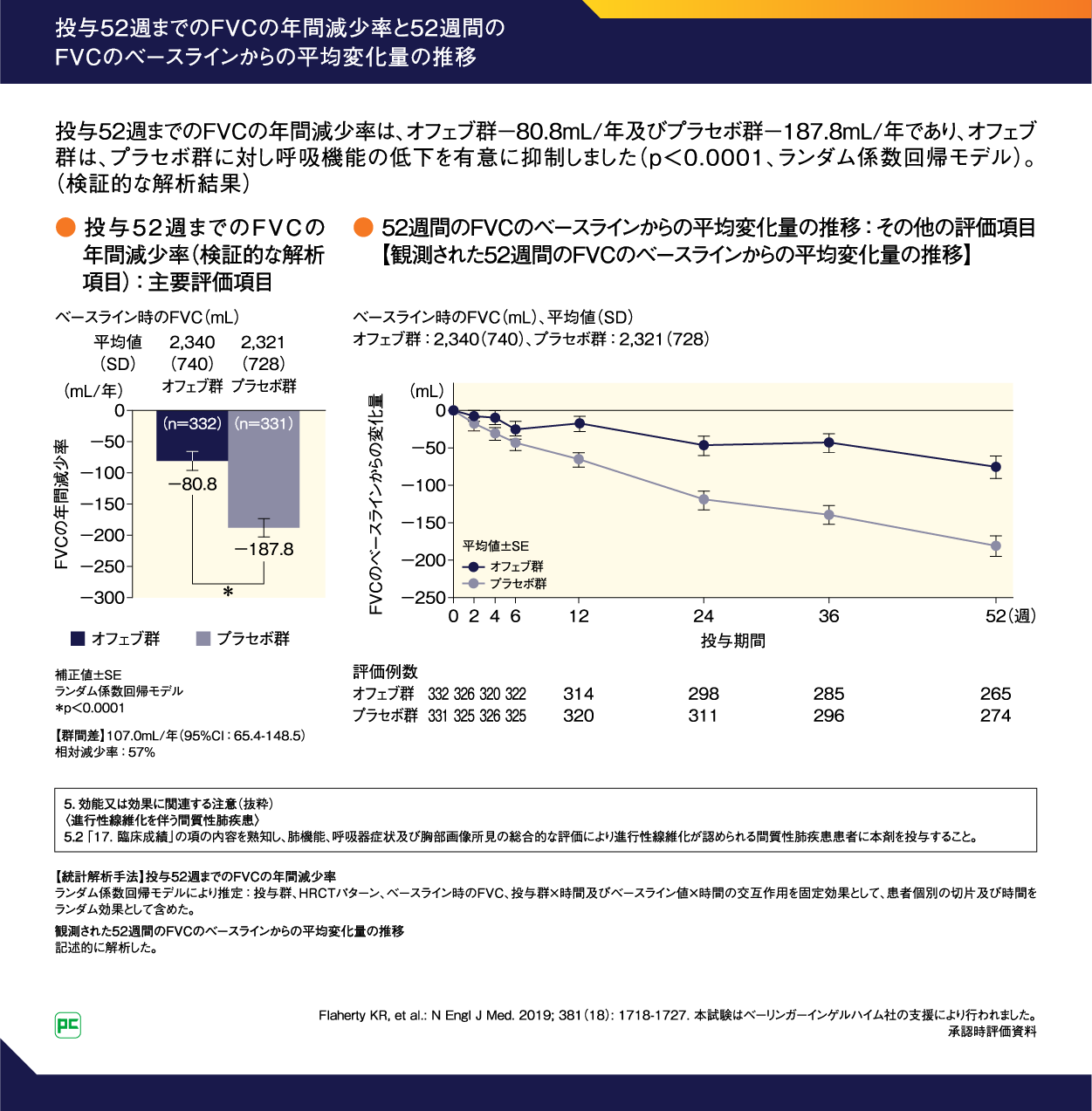
また、ベースライン時の%FVC別にみた投与52週までのFVCの年間減少率は、図15のとおりでした。
図15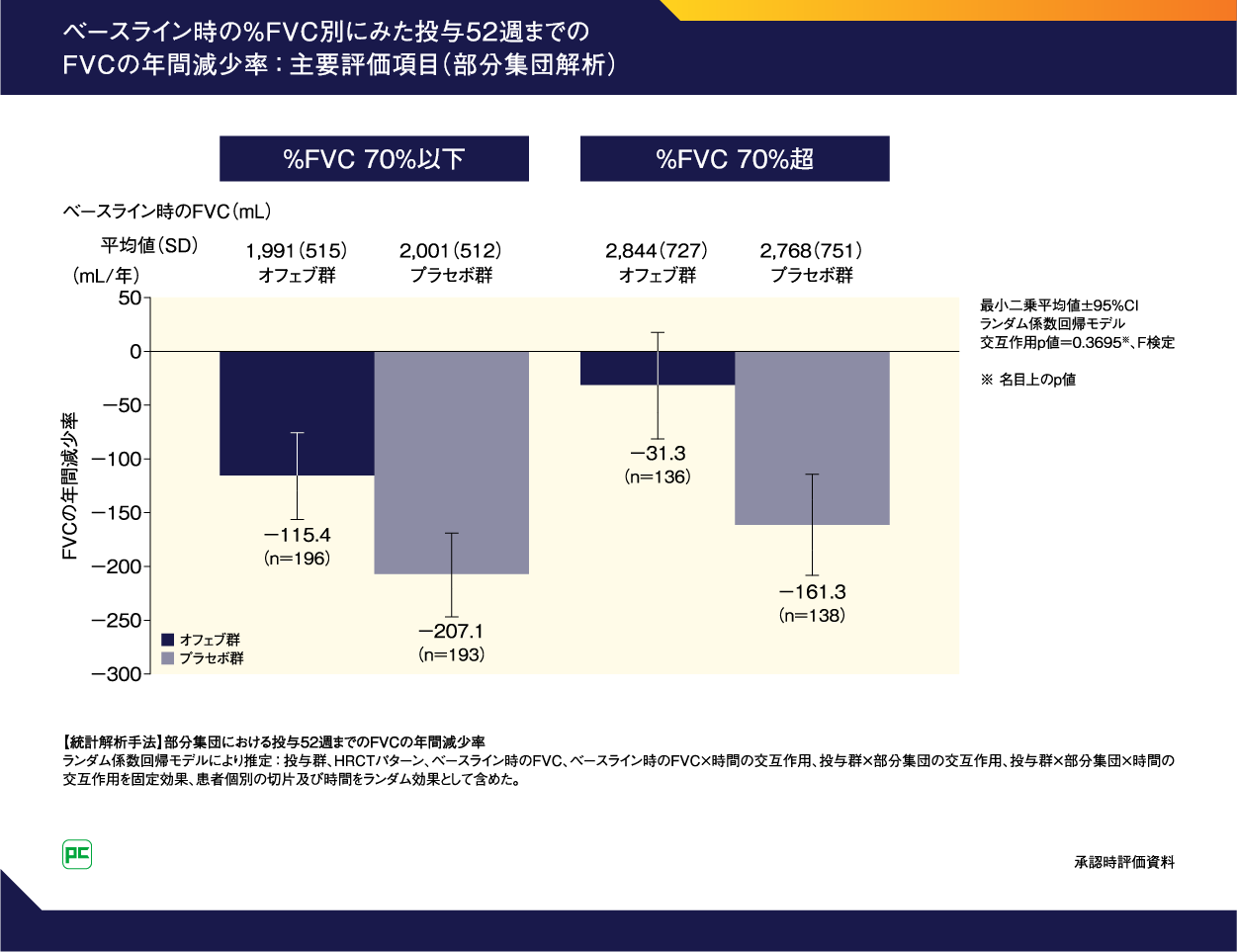
オフェブの呼吸器症状に対する影響
INBUILD試験では、オフェブの呼吸器症状に対する影響について、L-PFスコアを用いて検討されました(図16)。L-PFスコアは、肺線維症患者さんにおける症状に関する評価指標であり、symptomsとsymptom以外の広範な生活への影響を示すimpactsという2つのモジュールからなる44項目の質問で構成されます。なお、symptomsモジュールは、呼吸困難、咳嗽、疲労の3つのドメインで構成されています。symptoms及びimpactsスコアからL-PF総スコアが計算されます。
総スコアおよびドメインスコアの範囲は0~100であり、スコアが高値であるほど、症状が重いことを示します。
図16
ベースライン時のL-PFスコアをお示しします。(表2)。
表2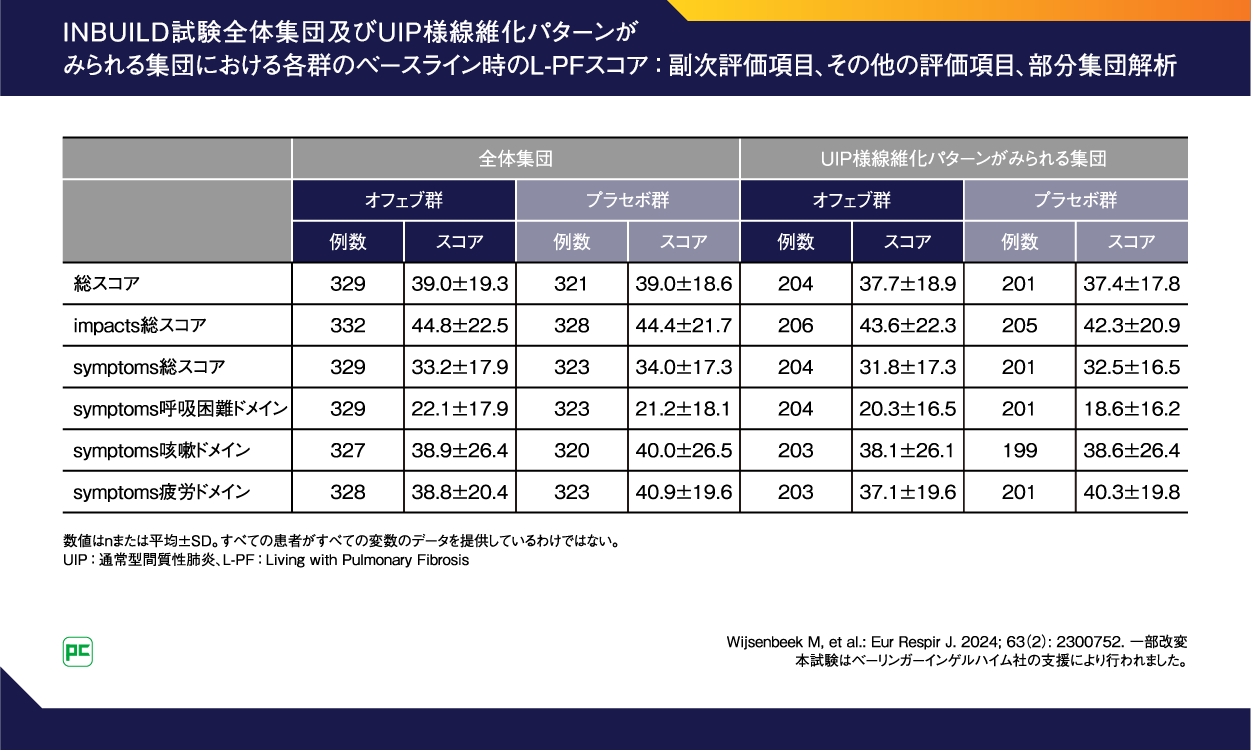
INBUILD試験全体集団の投与52週時におけるL-PF総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群0.5、プラセボ群5.1、群間差は-4.6(95%CI:-7.1--2.2)でした(p=0.0002、名目上のP値)(図17)。L-PF impacts総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群-0.2、プラセボ群4.6、群間差は-4.9(95%CI:-7.7--2.0)でした(p=0.0008、名目上のP値)。L-PF symptoms総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群1.3、プラセボ群5.3、群間差は-4.0(95%CI:-6.4--1.6)でした(p=0.0011、名目上のP値)。symptoms呼吸困難ドメインスコア、symptoms咳嗽ドメインスコア、symptoms疲労ドメインスコアについては、図17のとおりです。
図17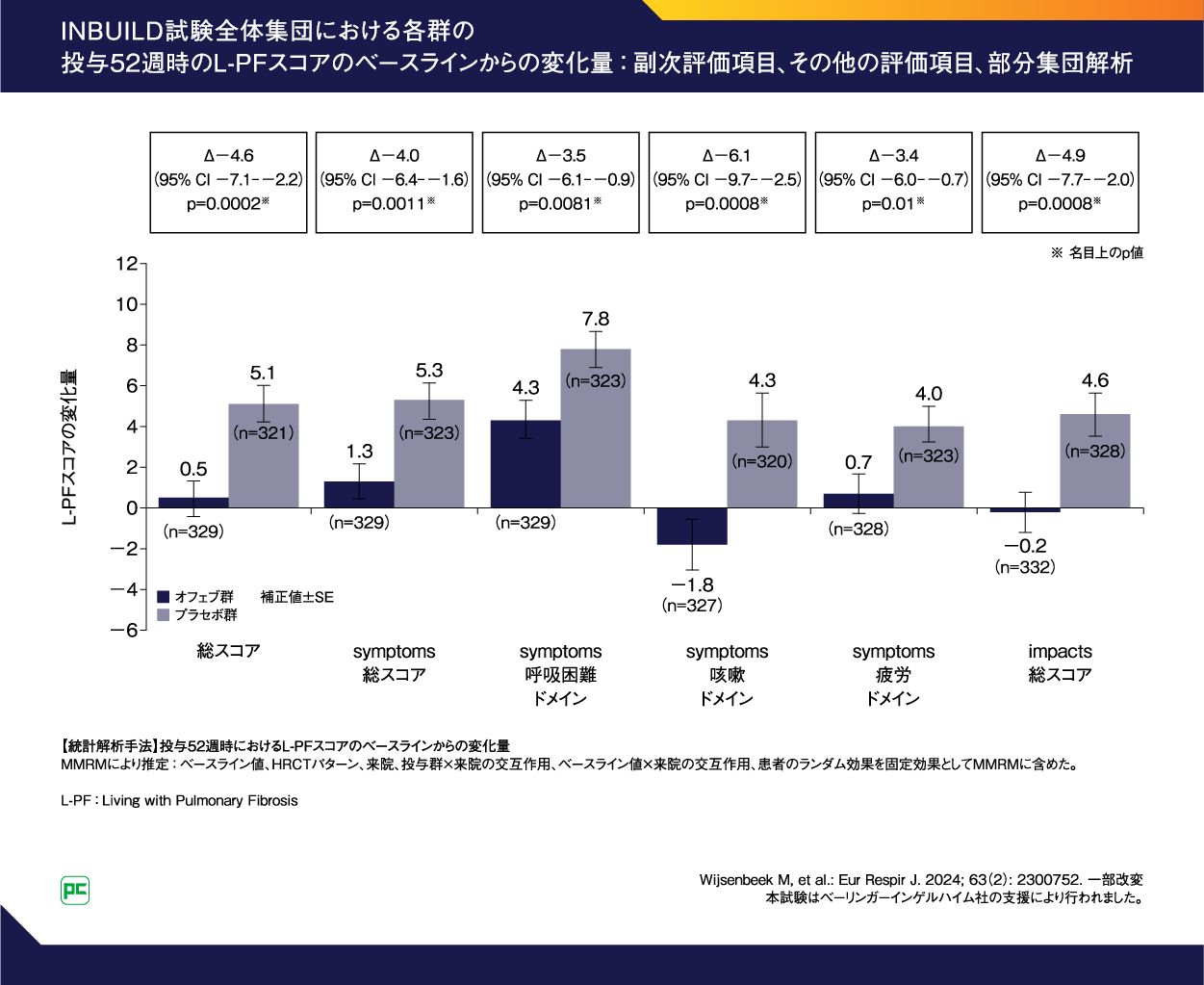
HRCTにおいてUIP様線維化パターンがみられる集団(co-primary評価集団・部分集団解析)の投与52週時におけるL-PF総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群0.2、プラセボ群5.5、群間差は-5.3(95%CI:-8.3--2.2)でした(p=0.0008、名目上のP値)(図18)。L-PF impacts総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群-0.2、プラセボ群4.9、群間差は-5.1(95%CI:-8.7--1.5)でした(p=0.0053、名目上のP値)。L-PF symptoms総スコアのベースラインからの平均変化量(MMRMにより推定)は、オフェブ群0.9、プラセボ群5.7、群間差は-4.9(95%CI:-7.9--1.8)でした(p=0.0019、名目上のP値)。symptoms呼吸困難ドメインスコア、symptoms咳嗽ドメインスコア、symptoms疲労ドメインスコアについては、図18のとおりです。
図18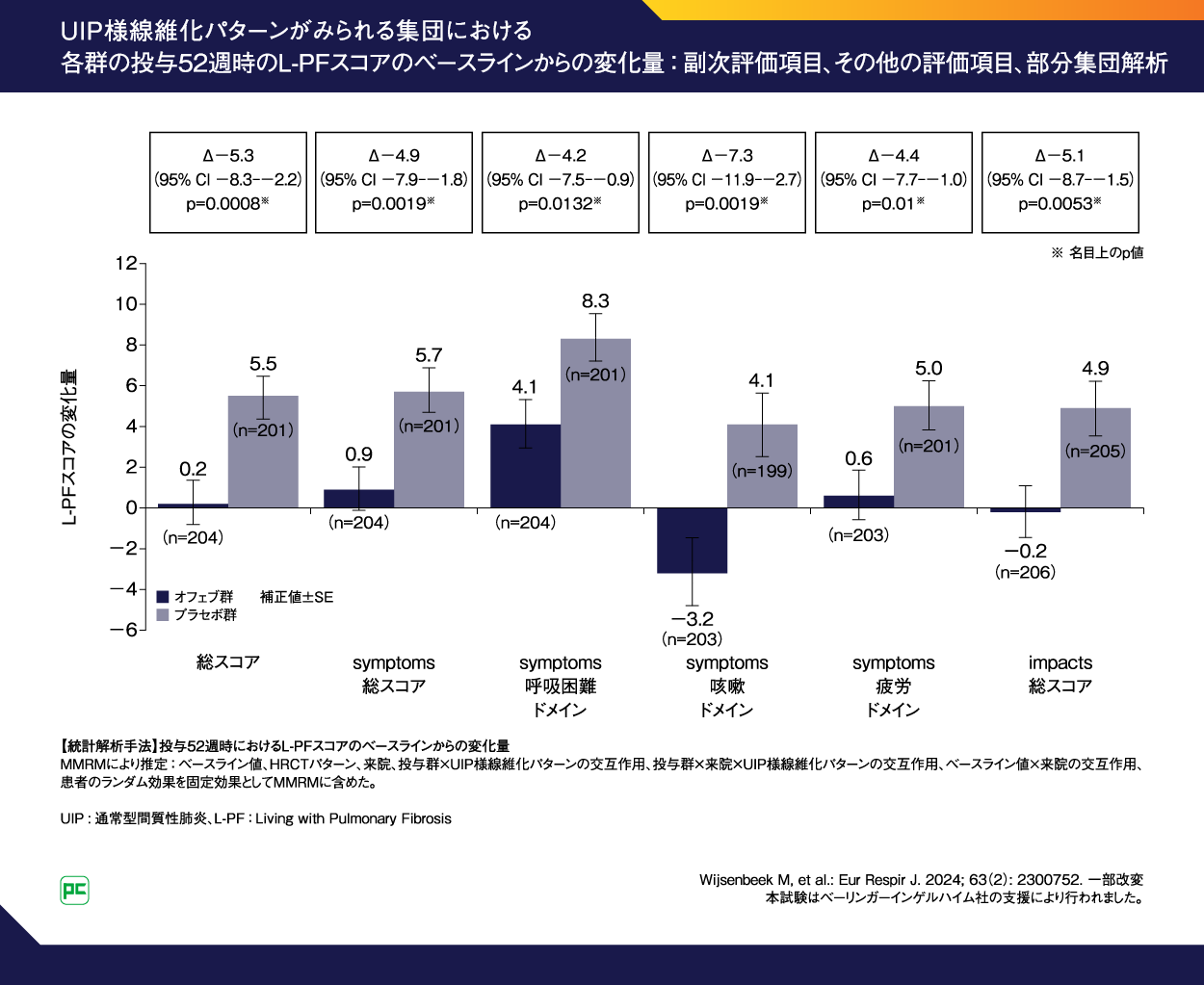
オフェブの安全性
INBUILD試験の全期間における有害事象は、オフェブ群で326例(98.2%)、プラセボ群で308例(93.1%)に認められました。オフェブ群における重篤な有害事象として主なものは肺炎24例、間質性肺疾患19例、急性呼吸不全16例などでした。オフェブ群において投与中止に至った有害事象は下痢21例、ALT増加6例、薬物性肝障害5例などであり、死亡に至った有害事象は、急性呼吸不全4例、呼吸不全3例などでした(表3)。
表3
主な有害事象は、発現頻度が高い順にオフェブ群で下痢240例(72.3%)、悪心100例(30.1%)、嘔吐64例(19.3%)など、プラセボ群で下痢85例(25.7%)、気管支炎64例(19.3%)、呼吸困難57例(17.2%)などでした(表4)。
表4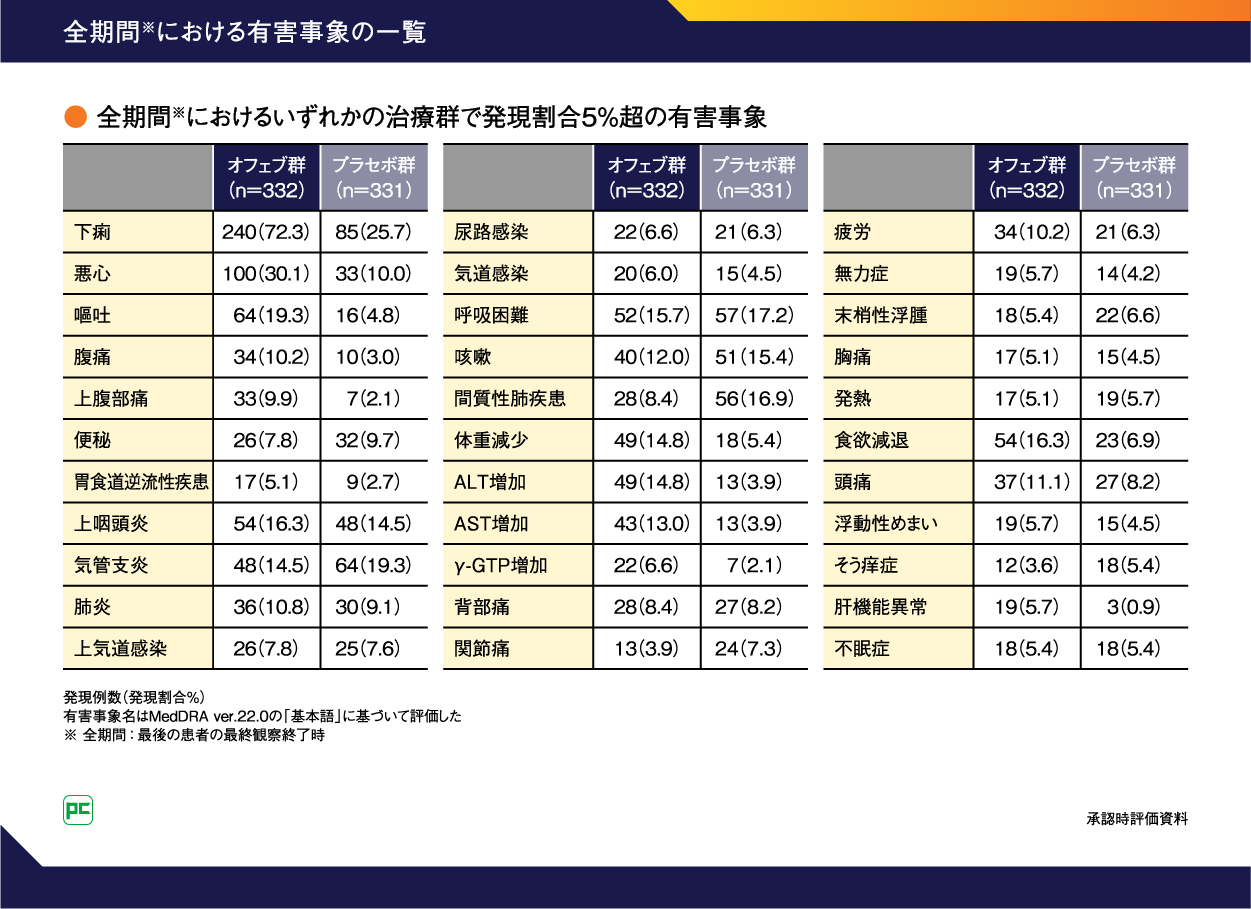
投与52週までの下痢、嘔吐、悪心、肝酵素上昇の有害事象の重症度をお示しします。オフェブ群において、下痢は、有害事象共通用語規準を用いた評価ではGrade 1が66.5%、Grade 2が23.1%、Grade 3が10.4%でした。嘔吐と悪心、肝酵素上昇は有害事象の重症度の判定基準を用いて評価しています。嘔吐は軽度が78.7%、中等度が21.3%、悪心は軽度が80.2%、中等度が19.8%でした。肝酵素上昇は軽度が69.7%、中等度が27.6%、高度が2.6%でした(表5)。
表5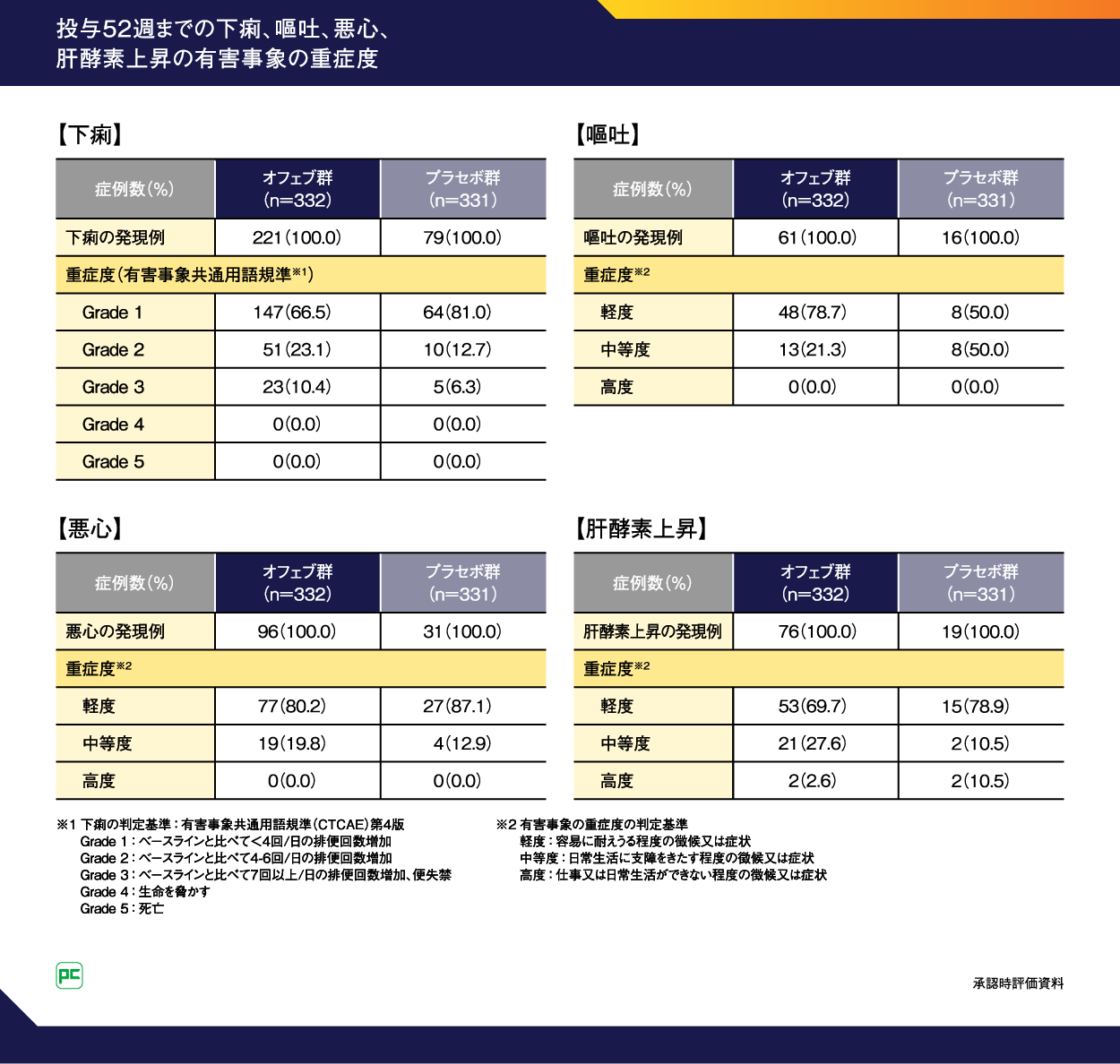
まとめ
ILDはRAの疾患活動性に関連するだけでなく、患者さんの予後にも影響を及ぼすと考えられています。
RA治療においては、まずはRAの臨床的寛解、低疾患活動性の達成を目指すとともに、ILDの進行が明らかな場合には、ILD の疾患挙動の評価を定期的に実施することが大切です。
PF-ILDに該当し、線維化優位/UIPパターンを示すILDが確認された際には、オフェブによる治療介入もご検討ください。
今回ご紹介した内容を、RA-ILD患者さんのご診療にお役立ていただけますと幸いです。
その他の関連情報


特発性肺線維症および進行性肺線維症 国際診療ガイドライン2022(静止画)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



