進行性肺線維症(PPF):用語をめぐる状況と今後の展望(静止画)
サイトへ公開:2025年11月27日 (木)
クイックリンク

2022年に米国胸部学会(ATS)、欧州呼吸器学会(ERS)、日本呼吸器学会(JRS)、ラテンアメリカ胸部医学会(ALAT)による国際診療ガイドラインで発表された、「進行性肺線維症(progressive pulmonary fibrosis:PPF)」という用語に関する背景、現状、そして今後の展望についての論評(commentary)1)が発表されましたので、ご紹介します。
目的と背景について示します(図1)。
本論評は、「進行性肺線維症(“PPF”)」および「進行性線維化を伴う間質性肺疾患(“PF-ILD”)」という用語の背景と概念を検討し、呼吸器専門医とリウマチ専門医に、抗線維化治療が可能となった時代における“PPF”の概念について、より深い理解をもたらすことを目的としています。
本論評では、背景として次のようなことがあげられます。
- 2013年のATS/ERSの疾患分類など、これまでの分類は背景疾患や病因に基づいており、マネジメントに重要な意味をもつ線維化や、臨床症状の類似性などへの考慮が十分ではありませんでした。
- 疾患への理解や治療法が進歩するにつれ、炎症や線維化といった背景の病態に基づく分類が提案されるようになってきました。
- ILDのなかで、特発性肺線維症(IPF)以外に進行性の線維化を伴う疾患があることが明らかになってきました。
- ニンテダニブの臨床試験(INBUILD試験)2)で提案された“PF-ILD”が広く使用されるようになったなかで、新たに“PPF”が提案されたため混乱が起きています。
図1

“PPF”の定義・基準に関する未解決の問題・課題を表に示します(図2)。
ポイントは、“PPF”は2022年のATS/ERS/JRS/ALAT IPFおよびPPF国際診療ガイドライン3)(以下、ガイドライン)で新たに提案された概念であり、臨床試験のエビデンスというより、エキスパートのコンセンサスに基づいている点です。一方、“PF-ILD”は、INBUILD試験というランダム化比較試験で用いられ、診断基準としての有用性が少なくとも部分的に検証されています。このことからも、“PPF”の臨床的有用性については、今後の研究による検証が求められます。
図2

その他の“PPF”の定義・基準に関する未解決の問題・課題を表に示します(図3)。
図3

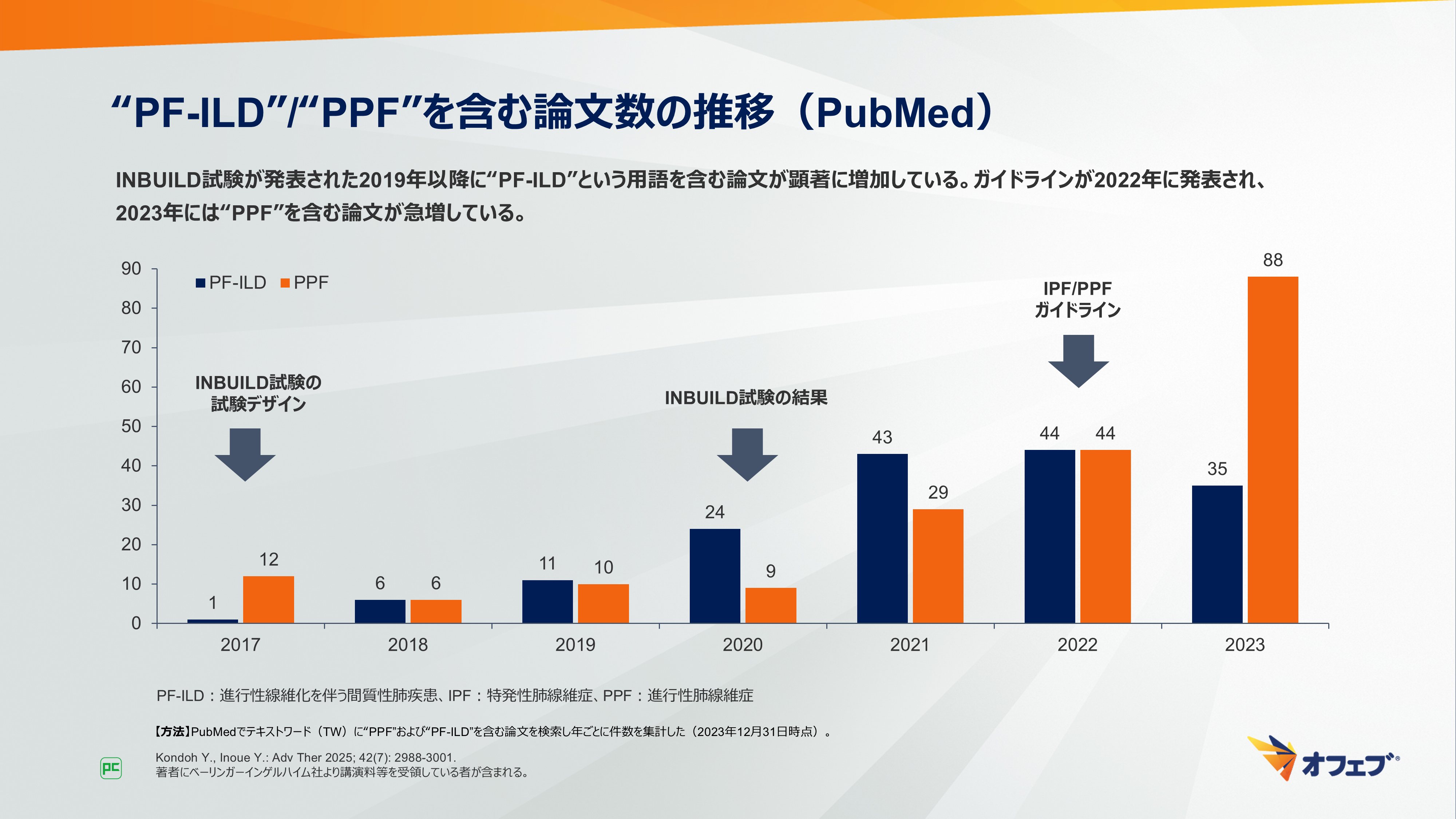
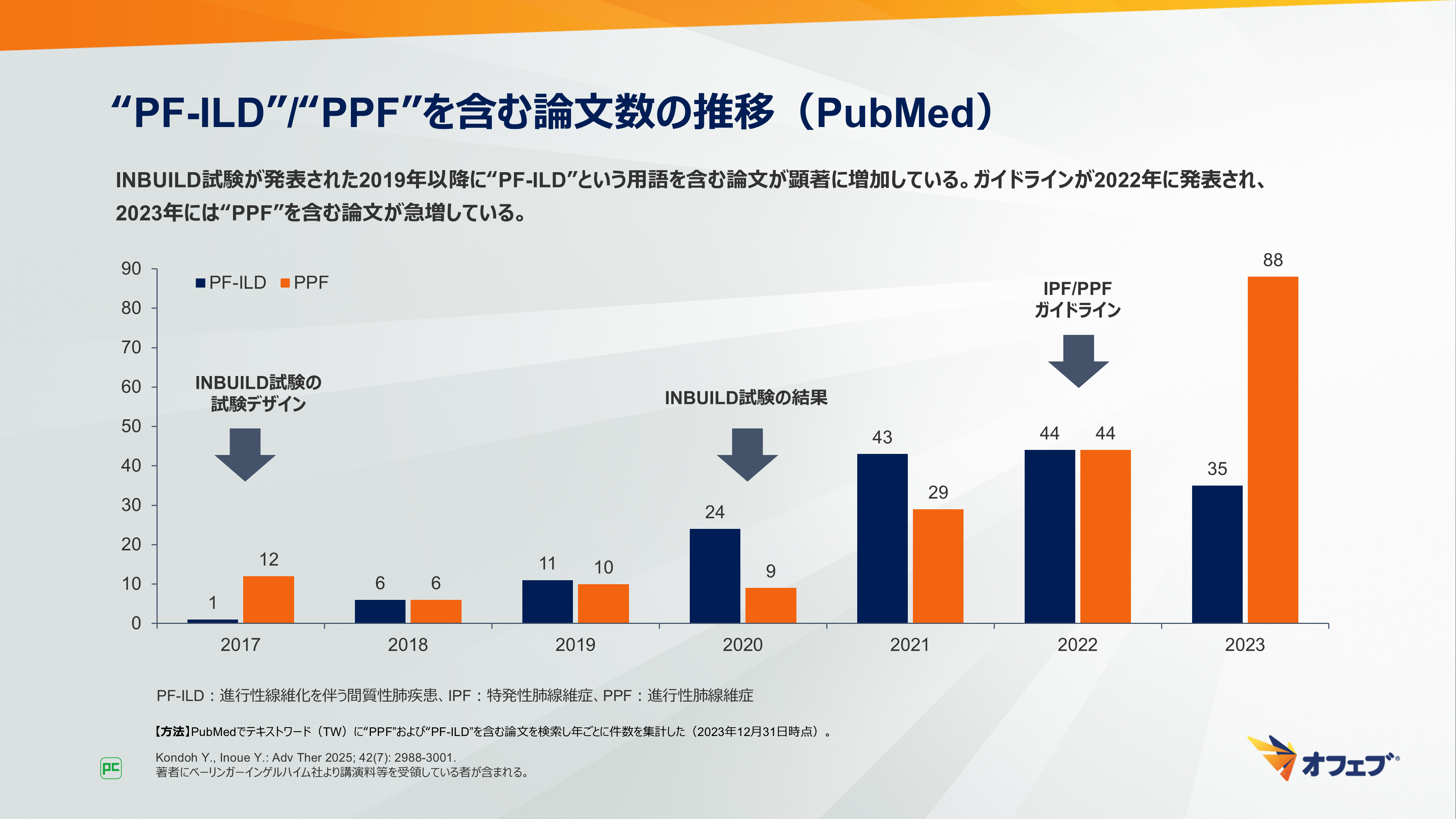
“PF-ILD”/“PPF”を含む論文数の推移について示します(図4)。
PubMed上の論文数をみてみると、INBUILD試験が学会発表された2019年以降に“PF-ILD”という用語を含む論文が顕著に増加しています。この用語が臨床において、呼吸器専門医やリウマチ専門医の間で浸透していく時期と一致していると考えられます。
図4
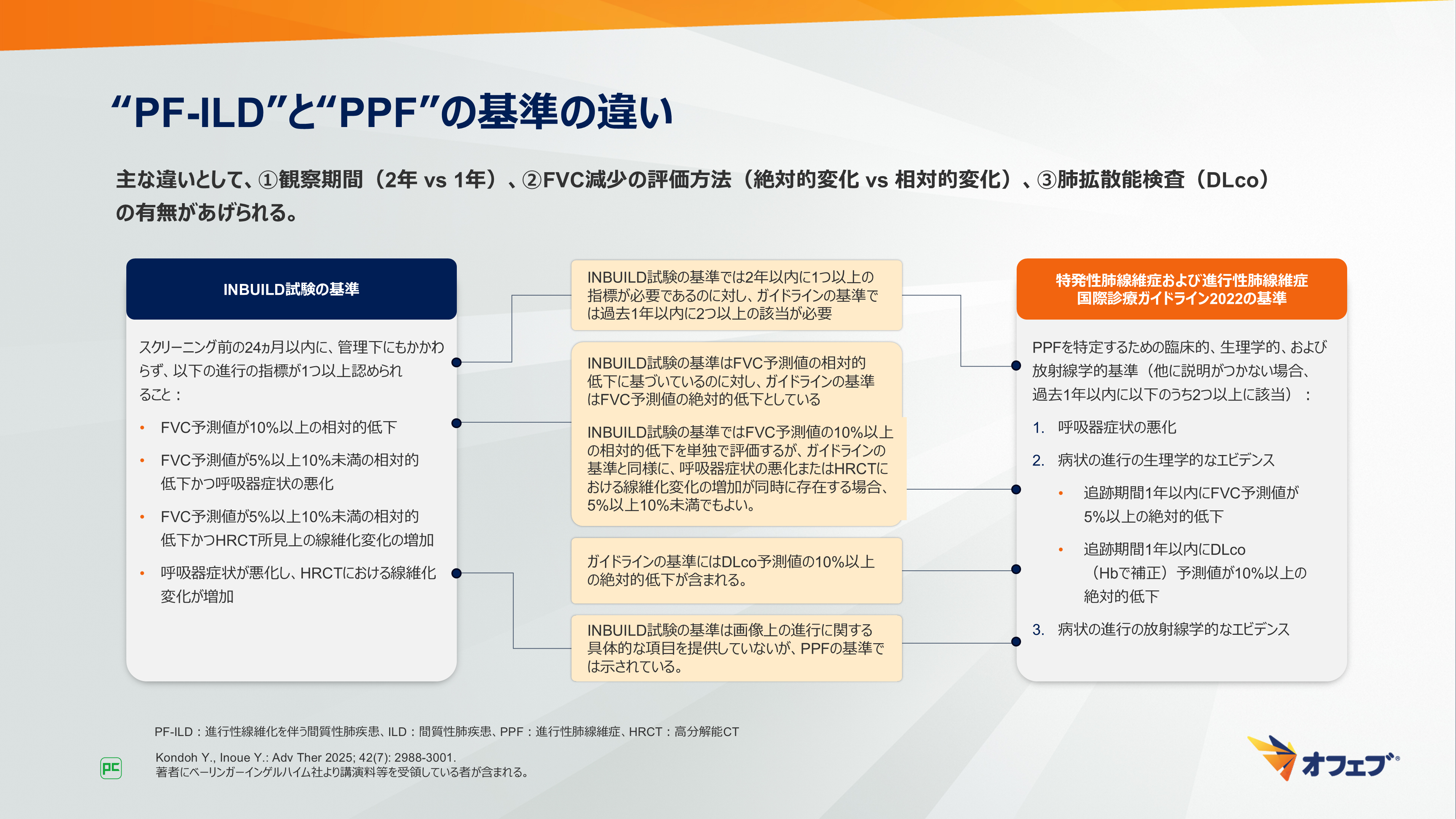
INBUILD試験で用いられた“PF-ILD”と、ガイドラインで提案された“PPF”の基準の違いについて示します(図5)。
“PF-ILD”は、24ヵ月以内に、管理下にもかかわらず、以下の進行の指標が1つ以上認められることと定義されています。進行の指標とは、
- FVC予測値が10%以上の相対的低下
- FVC予測値が5%以上10%未満の相対的低下かつ呼吸器症状の悪化
- FVC予測値が5%以上10%未満の相対的低下かつHRCT所見上の線維化変化の増加
- 呼吸器症状が悪化し、HRCTにおける線維化変化が増加
です。
“PPF”は、過去1年以内に以下の臨床的、生理学的、および放射線学的基準のうち2つ以上に該当する場合と定義されています。これらの基準とは、
- 呼吸器症状の悪化
- 病状の進行の生理学的なエビデンス
- 追跡期間1年以内にFVC予測値が5%以上の絶対的低下
- 追跡期間1年以内にDLco(Hbで補正)予測値が10%以上の絶対的低下
- 下記の1つ以上に該当する病状の進行の放射線学的なエビデンス
- 牽引性気管支拡張および細気管支拡張の範囲の拡大または重症度の悪化
- 牽引性気管支拡張を伴う新たなすりガラス影
- 細かい網状影の新規出現
- 網状影の範囲の拡大ないし粗大化
- 蜂巣肺の出現ないし増加
- 肺葉容積減少の増加
です。
2つの基準の主な違いとして、
- 観察期間(2年 vs 1年)
- FVC予測値の低下の評価方法(絶対的低下vs相対的低下)
- 肺拡散能検査(DLco)の有無
の3点があげられます。
“PPF”の「追跡期間1年以内にFVC予測値が5%以上の絶対的低下」という基準は、IPFにおけるエビデンスから推定されています。また、絶対的低下の方が臨床的に使用しやすい点も考慮されています。
“PPF”の基準では、DLcoも様々な線維性のILDで予後予測因子とされていることから採用されています。また、再現性に影響を及ぼす測定の技術的な課題があることから10%という高い閾値が設定されています。DLcoは施設間での測定方法の標準化という課題はあるものの、普及度と測定の簡便さから臨床上も意味のある検査と考えられます。
なお、“PPF”の基準では放射線学的エビデンスについて詳細な記載がありますが、これはCTによる進行と線維化の検査が定期的に行われていることを反映しています。
図5
“PPF”という用語が提案された背景について示します(図6)。
“PPF”を提案する際の根拠として、ガイドラインでは次のような点が示されました。
- 疾患進行は、肺実質における間質腔を超えた進行性の肺線維化の結果として起こる。
- 疾患進行は、IPF患者の臨床経過と同様である。
- PPFはシンプルで広く知られ、現在臨床医と患者の両方に使用されている「肺線維症(pulmonary fibrosis)」の用語と互換性がある。
また、ガイドラインでは、“PPF”は診断名というより「疾患挙動(disease behavior)」を表しており、INBUILD試験における“PF-ILD”と同じような、適切な疾患管理にもかかわらず進行性の線維化を呈する患者を示すものであると明示しています。
ガイドライン委員会では、単一の試験が抗線維化治療を導くべきではないと考えているため、“PPF”という基準は多くの臨床試験を反映して作成されています。しかし、“PPF”という新たな基準が関連するのは予後のみであり、この基準によって抗線維化治療に最適な患者を特定できるかは明らかになっていないという点は注意すべきです。
図6

PPFの定義・基準と予後の関連についての研究について示します。
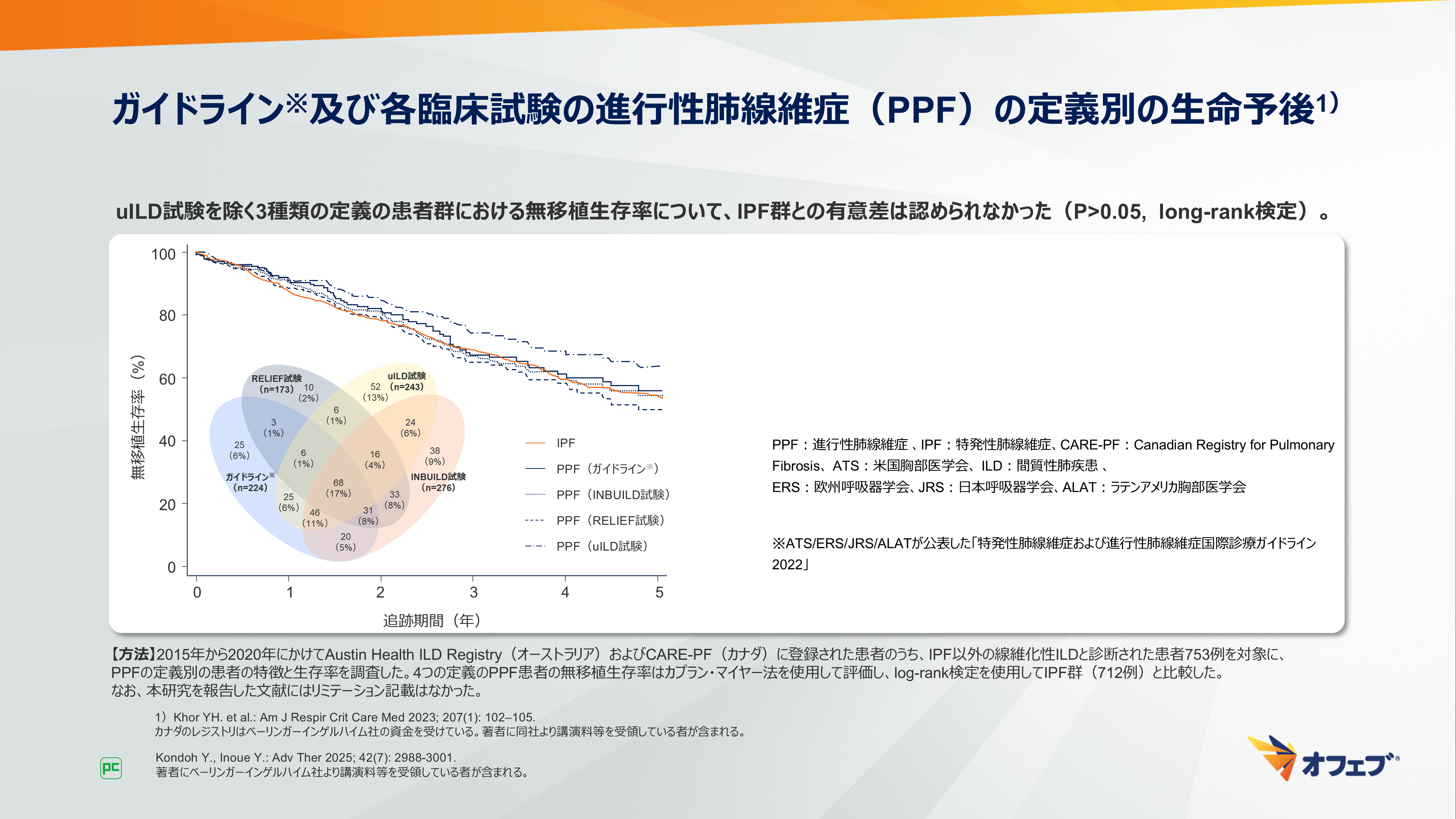
オーストラリアおよびカナダのレジストリに登録されたIPF以外の線維化性ILD患者(753例)を対象に、様々なPPFの定義を用い、各定義に合致する患者の予後を比較した後方視多施設コホート研究4)について示します(図7)。
用いたのは、3つの臨床試験(INBUILD試験、RELIEF試験、uILD試験)とガイドラインにおける定義です。
4つの定義のうち、1つに合致したのが403例(54%)、4つすべてに合致したのは68例(17%)でした。INBUILD試験の定義に合致した276例のうち54例(20%)は、FVC予測値の10%以上の相対的低下による判定でした。
予後を無移植生存(TFS)期間で検討したところ、uILD試験を除く3種類の定義の患者群における無移植生存率について、IPF群との有意差は認められませんでした(P>0.05、long-rank検定)。1年および3年の無移植生存(TFS)患者割合は、ガイドラインの患者群とINBUILD試験の患者群では、同じく91%、68%でした。
図7
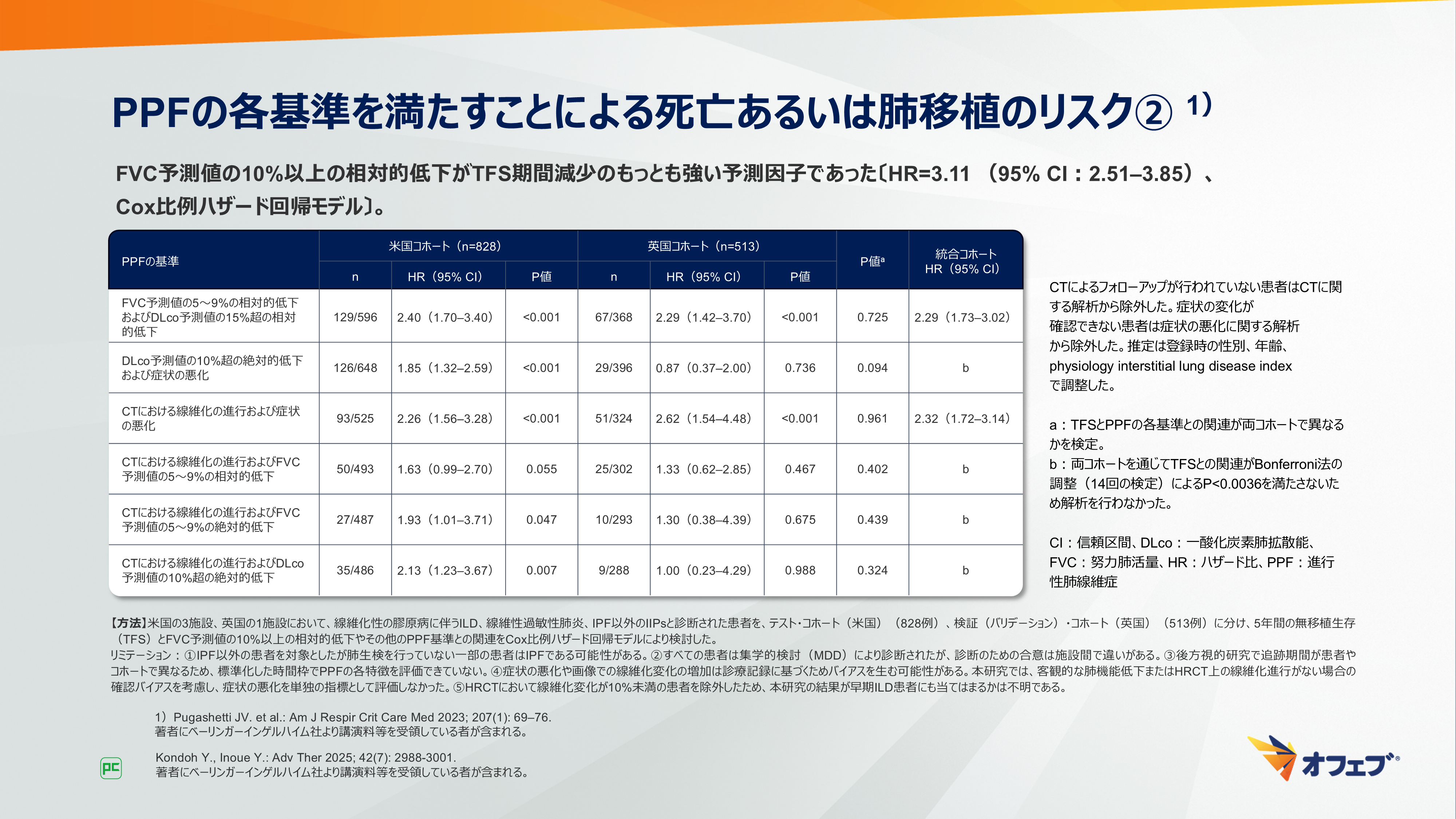
米国および英国でIPF以外のILD患者(1,341例)を対象に、様々なPPFの基準によって無移植生存(TFS)を予測できるかを検討した後方視多施設コホート研究5)について示します(図8、9)。
FVC予測値の10%以上の相対的低下がTFS期間減少のもっとも強い予測因子であり〔HR=3.11 (95% CI:2.51–3.85)、Cox比例ハザード回帰モデル〕、コホート、ILD病型、治療に関わらない一貫したTFSとの関連を示しました。また、参照コホートであるIPF患者と類似した経過を示しました。
FVC予測値の10%以上の相対的低下を除いた場合では、6つの基準とTFS期間減少との関連が示されました。FVC予測値の5~9%の相対的低下、DLco予測値(Hbで補正)の15%を超える相対的低下、CTにおける線維化の進行は単独の因子として、さらに生理学的所見、放射線学的所見、症状の悪化による3つの組み合わせが関連することが示されました。3つの組み合わせは単独の因子と同程度の関連が示されましたが、対象患者は少数でした。
その他に、米国でILD患者5,934例を対象に行われた後方視単施設コホート研究6)では、INBUILD試験およびガイドラインの基準で評価された患者群の24ヵ月の累積疾患進行割合はそれぞれ33.1%、37.9%と同程度でした。
図8
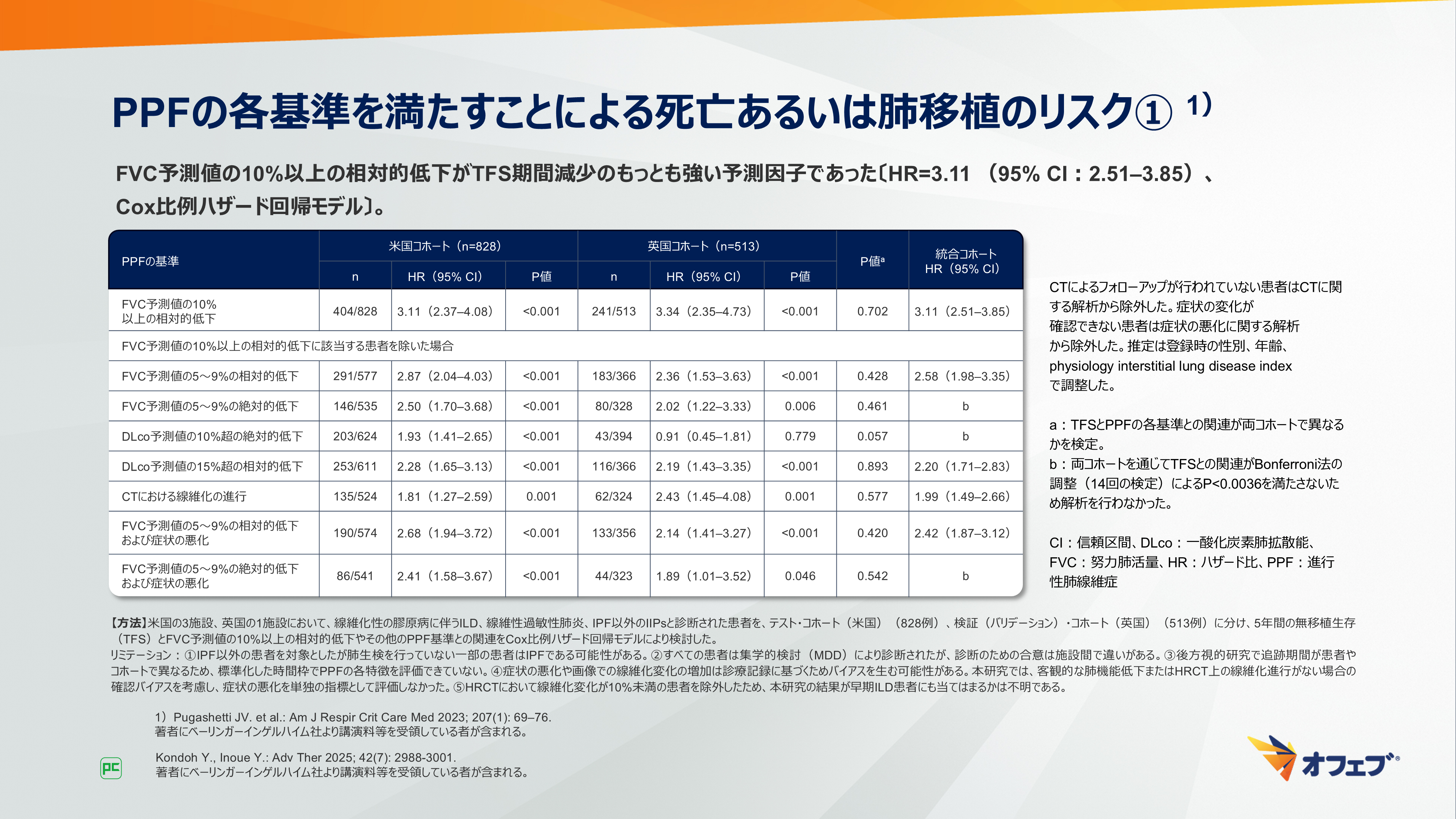
図9
先ほども示したとおり、PubMedの論文数をみてみると、INBUILD試験の試験デザインが発表された2017年以降、“PPF”と“PF-ILD”を含む論文数は徐々に増加し、ガイドラインが発表された2022年に両者とも過去最多となりました。その後、2023年には“PPF”を含む論文が急増し、“PF-ILD”を含む論文と大きく差を広げています(図10)。
図10
疾患挙動(Disease Behavior)を指す「進行性肺線維症(PPF)」と各臨床試験の基準について示します(図11)。
臨床試験が肺線維症の領域を進歩させ、用語にも大きな影響を与えていることは疑いようもありません。INBUILD試験が、そのタイトルに“PF-ILD”という用語を用いたことは、試験デザインが発表された2017年および結果が発表された2019年に“PF-ILD”を含む論文数が増加していることに大きく寄与しています。
ガイドラインの“PPF”とは、1年間で、呼吸器症状の悪化、生理学的な病状の進行、放射線学的な病状の進行のうち2つ以上に該当する場合です。
INBUILD試験の基準は、標準治療を施行しているにもかかわらず、2年間でFVC予測値が10%以上の相対的低下または、以下の指標の2つ以上に該当する場合です。その指標とは、FVC予測値が5%以上10%未満の相対的低下、呼吸器症状の悪化、画像上の進行です。
RELIEF試験の基準は、標準治療を施行しているにもかかわらず、6~24ヵ月以内の3回以上の測定でFVC予測値の年間低下率が5%以上です。
uILD試験の基準は、6ヵ月以内に、FVC予測値が5%超の絶対的低下または、著しい症状の進行です。
今後、新たに臨床試験の結果が発表される際に、“PPF”という用語が使われるかは注目すべきであり、そうなれば“PPF”は臨床試験から日常の臨床でも使用されるようになる可能性があります。その場合、“PF-ILD”という用語は“PPF”に置き換わっていくことになるでしょう。しかし、ガイドラインが示した“PPF”の基準を使用した臨床試験はこれまで行われていません。
そのため、“PPF”という用語は、IPFに似た「疾患挙動(disease behavior)」を指す包括的な用語(umbrella term)として受け入れられるようになってきました。
より明確な“PPF”の基準のためには、エビデンスとコンセンサスを得てさらなる評価を行うことが必要です。また、“PPF”という概念が普及するかどうかは、臨床試験での使用や、ガイドライン委員会による積極的な取り組みにかかっています。
図11

今後の展望について示します(図12)。
“PPF”と“PF-ILD”は診断基準と定義において異なっており、この違いがどのように治療の決定に影響するかという点について、エビデンスは十分ではありません。例えば、INBUILD試験では“PF-ILD”に対するニンテダニブの有効性が検討されましたが、“PPF”という診断基準を用いた場合に同様の治療戦略を適用できるかはわかりません。最適な治療戦略を確立するためには、基準の違いが治療戦略と予後にどのように影響を及ぼすかを検討する必要があります。
ガイドラインではいくつかの課題の解決が取り組まれていますが、多くの未解決の課題が残されています。例えば、PPF患者に対する一次治療は何か?背景因子や前治療に基づいて治療薬を使い分けるべきか?また、抗線維化薬のタイミングと使用順についての研究が求められます。
治療を行っても疾患が進行する場合だけでなく、将来の進行が予測される場合にどのような治療が適切かなど、進行の判定を行う前の管理基準を議論する必要もあるでしょう。
診断基準が進化することによって、将来の臨床医は、使用される用語に関係なく、臨床的エビデンスに基づいて、進行患者を適切に特定できるようになるでしょう。
図12

本論評の結論について示します(図13)。
- 非IPFのILDで進行性の患者を特定するための基準は多くありますが、将来的に使用される用語は“PPF”に統合されることが期待されます。
- 臨床医は、主要な臨床試験の基準を参照し、適切と判断される場合にはそれを臨床に応用することが推奨されます。
- PPFは研究が進歩しつつある領域であり、なぜILD患者の一部はPPFに進行するのか? 疫学や最適な治療戦略などについて多くの疑問が残されています。
図13

【参考文献】
- Kondoh Y., Inoue Y.: Adv Ther 2025; 427(7): 2988-3001. 著者にベーリンガーインゲルハイム社より講演料等を受領している者が含まれる。
- Flaherty KR. et al.: N Engl J Med 2019; 381(18): 1718-1727. 本試験はベーリンガーインゲルハイム社の支援により行われた。
- Raghu G. et al.: Am J Respir Crit Care Med 2022; 205(9): e18–47.
- Khor YH. et al.: Am J Respir Crit Care Med 2023; 207(1): 102–105. カナダのレジストリはベーリンガーインゲルハイム社の資金を受けている。著者に同社より講演料等を受領している者が含まれる。
- Pugashetti JV. et al.: Am J Respir Crit Care Med 2023; 207(1): 69–76. 著者にベーリンガーインゲルハイム社より講演料等を受領している者が含まれる。
- Macmurdo MG. et al.: Respir Med 2024; 227: 107656. 本研究はBoehringer Ingelheim Pharmaceuticals, Incの資金により行われた。著者に同社より謝金を受領している者が含まれる。著者に同社の社員が含まれる。
その他の関連情報


特発性肺線維症および進行性肺線維症 国際診療ガイドライン2022(静止画)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



