間質性肺炎合併肺癌に関するステートメント2025(静止画)
サイトへ公開:2025年11月27日 (木)
クイックリンク

2025年4月、日本呼吸器学会編集による「間質性肺炎合併肺癌に関するステートメント2025 改訂第2版」(以下、ステートメント2025)が発刊されました1)。ステートメント2025は、現時点における間質性肺炎合併肺癌についてどこまでのデータが存在するのかを明らかとし、今後何を明らかにするべきなのかを明確にすることを目的としています。
今回は、ステートメント2025において示された間質性肺炎合併肺癌の臨床像や診断フローチャート、治療について紹介します。
◆間質性肺炎合併肺癌の臨床像【ステートメント2025 第Ⅲ章-1.臨床像(疫学,血液検査含む)】
1.間質性肺炎合併肺癌の疫学
特発性間質性肺炎のなかで最も頻度の高い特発性肺線維症(IPF)においては多くの報告がされており、10~30%と比較的高率に肺癌が合併するとされています2)。IPF診断時における肺癌の合併頻度は2.0~16.7%、平均で6.1%とされています(表1)1)。IPFの死因のうち、肺癌は約10%を占めています3)。また、IPFでは喫煙で補正した肺癌発症危険率が5倍にもなります4)。さらに、一般人口に比較して間質性肺炎の患者は肺癌発症のリスクが3.5~7.3倍高くなるといわれています5)。
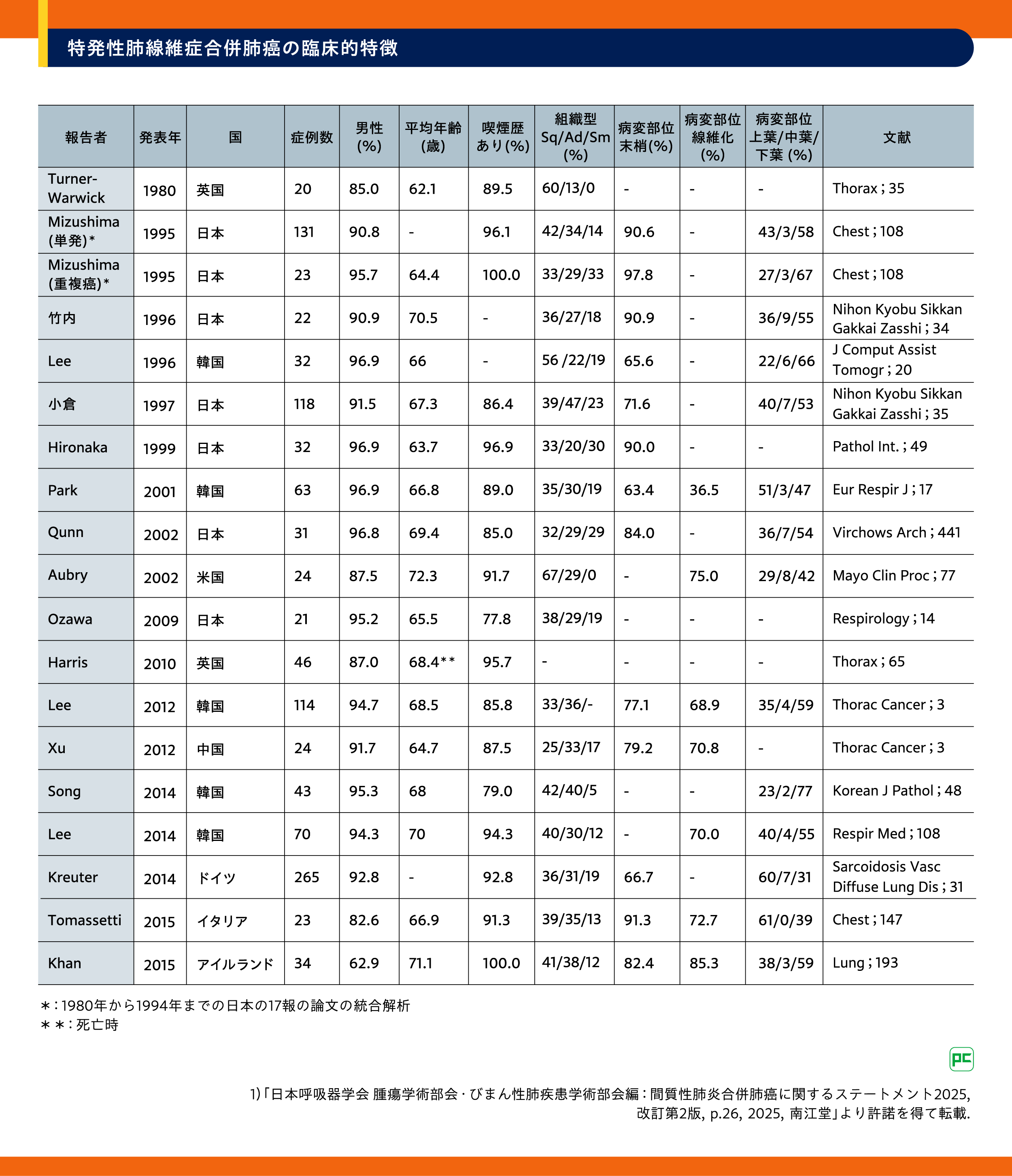
Mizushimaのグループにより、1980~1994年の15年間に本邦で報告されたIPF合併肺癌の報告から臨床的特徴がまとめられており、患者154例のうち131例が単発癌、20例が重複癌、3例が三重癌であったとされています6)。また、IPFでは喫煙男性の下葉末梢に扁平上皮癌の合併が多く、剖検例では小細胞癌を含む重複癌が多く報告されています(表2)1)。
表1
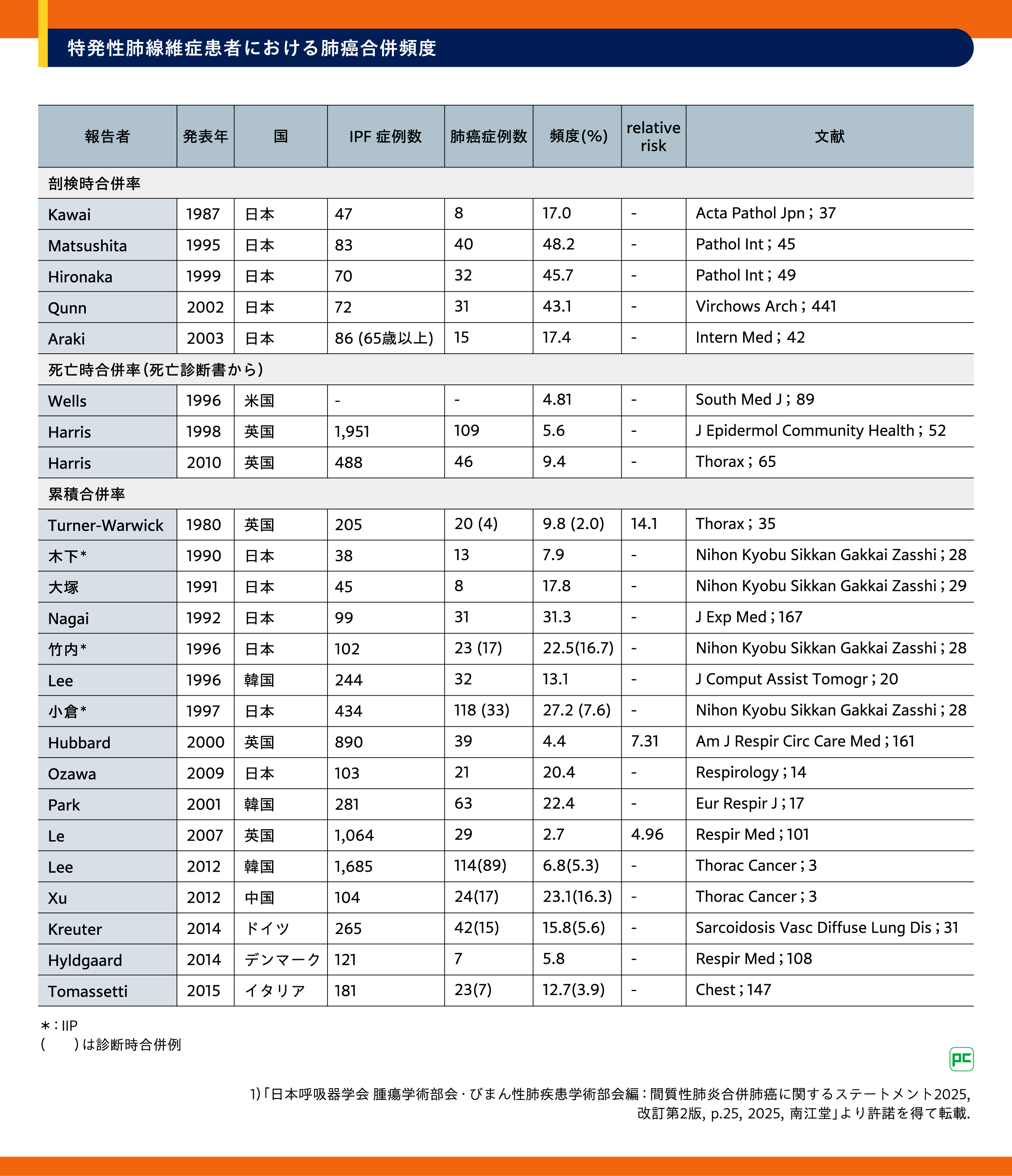
表2
2.間質性肺炎合併肺癌の臨床症状1)
間質性肺炎では慢性の乾性咳嗽と労作時呼吸困難が重要な症状であり、程度の変化にも注意が必要です。息切れの程度に関しては、修正MRCスケールで評価します。肺癌が合併すると体重の減少、食欲および身体活動性の低下を伴うことがあり、中枢型の肺癌では血痰、繰り返す肺炎などを伴うことがあります。一方、末梢型肺癌の合併では、呼吸困難に結びつく気胸、胸水などを伴うことがあります(表3)。
表3

3.間質性肺炎合併肺癌の生命予後
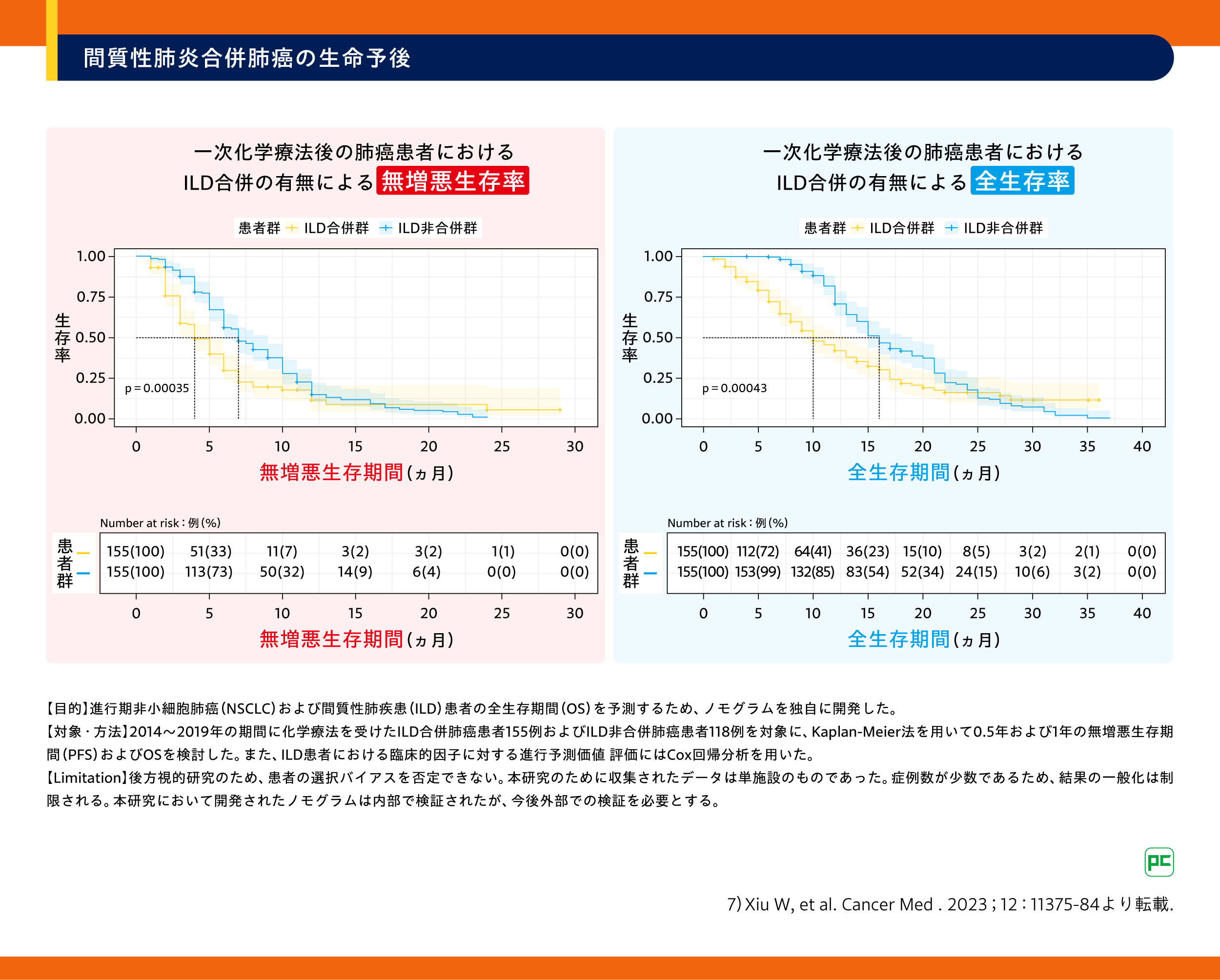
病期分類Ⅲ期以上の間質性肺炎合併肺癌では、間質性肺炎非合併例に比較して無増悪生存期間や全生存期間が3.0 vs. 7.0ヵ月、7.0 vs. 15ヵ月と有意に短くなっていることが報告されています(p=0.00035、p=0.00043、log-rank検定)(図1)7)。
図1
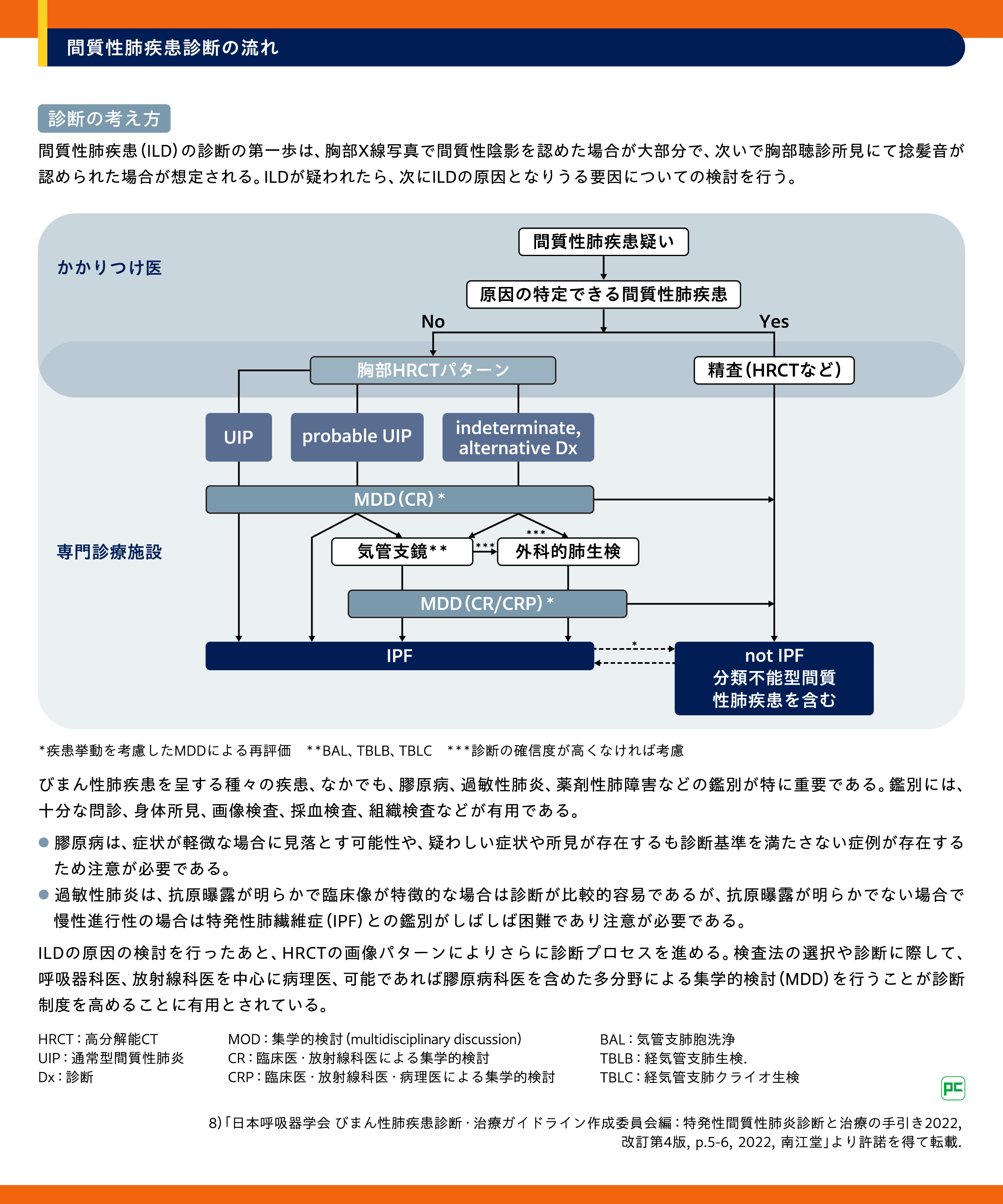
◆間質性肺炎合併肺癌の検査と診断【ステートメント2025 第Ⅲ章-4.診断フローチャート】
間質性肺疾患(ILD)の診断においては、主に胸部CTが行われます。ILDの特徴をさらに決定するには、環境、職業、その他の曝露(胸郭への放射線療法、特定の薬剤など)の評価と、ILDと関連しうる全身性疾患(関節リウマチ、全身性硬化症/強皮症など)の評価が重要です。場合によっては、基礎にある組織学的特徴を明らかにするために肺生検が必要となります(図2)8)。
図2
1.間質性肺疾患患者における肺癌の診断
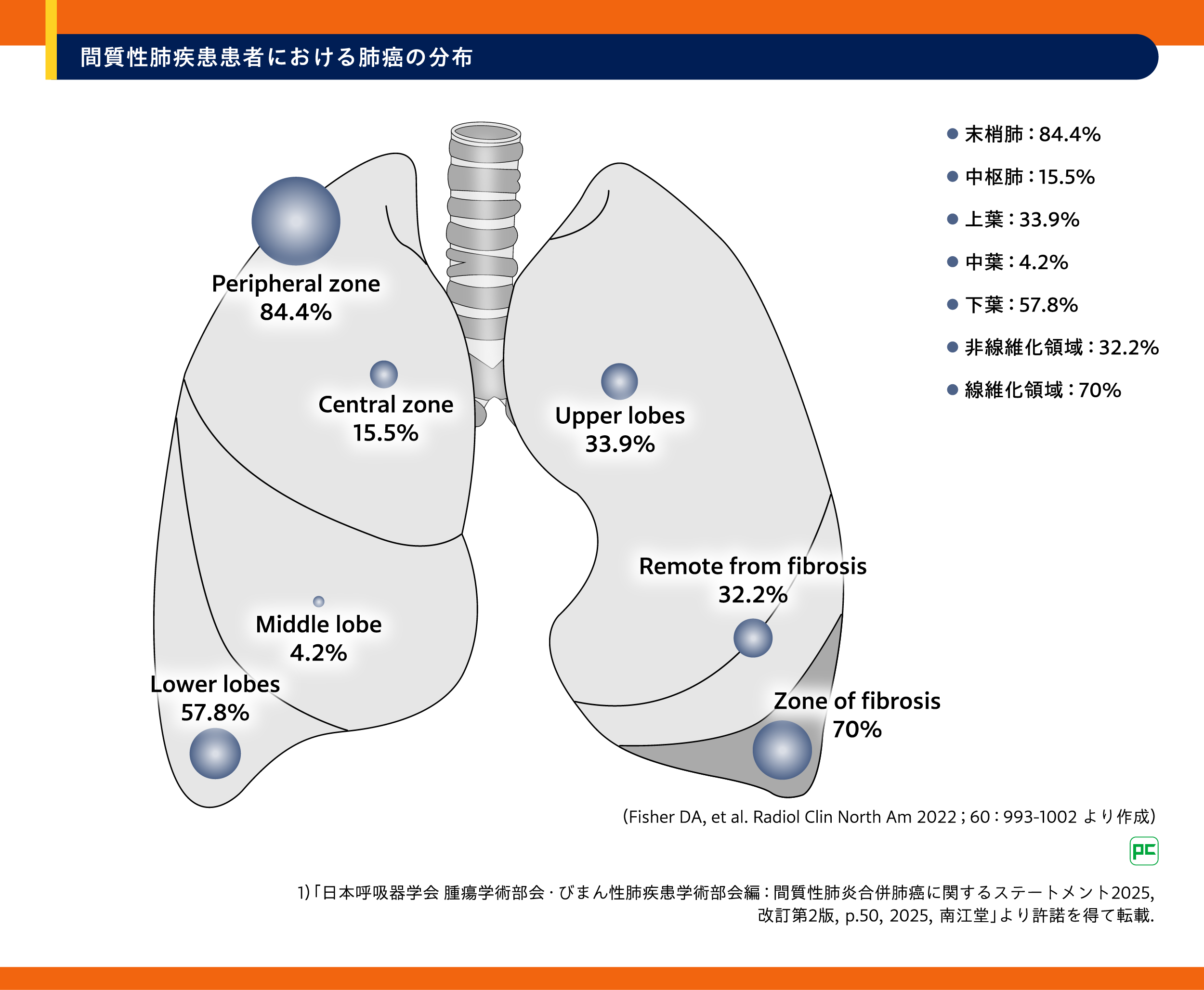
ILD患者では肺癌の発生率が高いにもかかわらず、ILDに特化した肺癌検診のガイドラインは存在しません。Lancet誌に2017年に掲載された専門家の意見書では、IPF患者の8mmまでの肺結節に対しては、年1回の高解像度胸部CT(仰臥位と腹臥位での薄い軸位スライス、さらに吸気像と呼気像)と、より頻繁な経過観察を、8mmを超える結節に対してはフルオロデオキシグルコース陽電子放射断層撮影コンピュータ断層撮影(FDG-PET/CT)が提案されています9)。IPF患者に発生する肺癌は、末梢性、下葉、線維化に近い部位に発生する傾向があり10)-12)(図3)、線維化病変部においては肺癌との鑑別がCT所見からは困難な場合があります。PET-CTはこのような場合において有用であるとされており、IPF患者55例を対象とした研究では、PET-CTによる悪性肺結節の検出感度は98%、特異度は86%と報告されています13)14)。
生検に踏み切る決定が下された場合、気管支鏡下生検(TBB)、電磁ナビゲーション気管支鏡検査(ENB)、CTNBまたは気管支内超音波ガイド下生検(EBUS-TBNA)などが選択肢としてあげられます。
図3
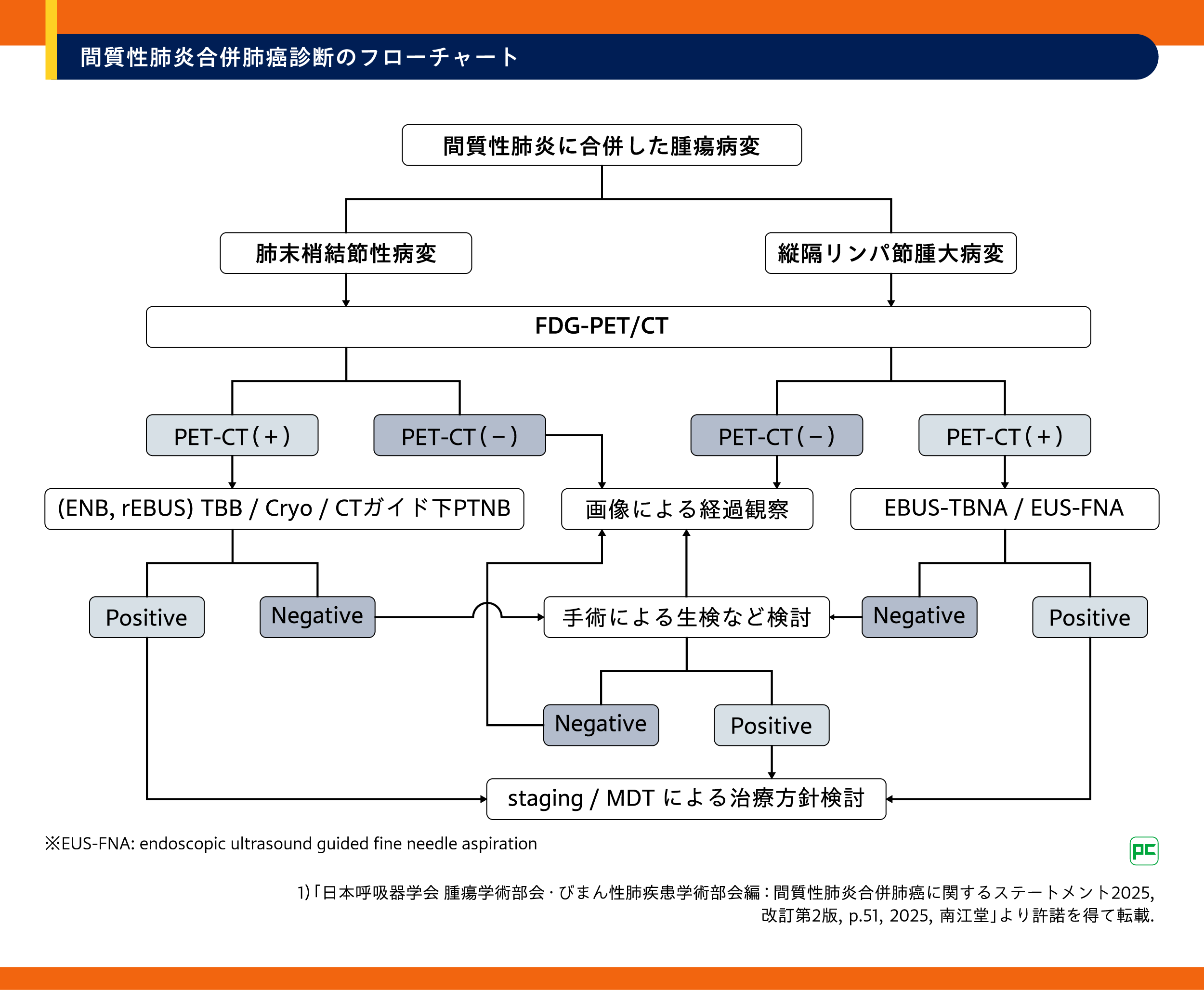
2.間質性肺炎合併肺癌診断のフローチャート
ステートメント2025では、診断のエビデンスに基づき診断のフローチャートが提示されています(図4)1)。画像診断においてはFDG-PET/CTが有用とされ、生検診断においては末梢病変に対して気管支内超音波(rEBUS)を用いたTBB、クライオバイオプシーなどが検討され、肺門縦隔リンパ節病変に対してはEBUS-TBNA、EUS-FNAなどが用いられます。
図4
◆間質性肺炎合併肺癌の治療【ステートメント2025 第Ⅳ章-1.間質性肺炎合併肺癌の治療総論】
1.間質性肺炎合併肺癌治療の実情
間質性肺炎合併肺癌に対する治療介入では、薬物治療、放射線治療、外科治療が行われます(表4)。薬物治療においては、細胞傷害性抗癌薬、分子標的治療薬、免疫チェックポイント阻害薬が用いられます。しかしながら、治療介入によって間質性肺炎の急性増悪を引き起こす可能性があるため、現状では治療介入が生存期間を延長させるかどうかについては明らかになっていません。そのため、実際の臨床現場ではリスクとベネフィット、さらに患者や家族の希望も含めて治療を行うべきかどうかを症例ごとに慎重に判断しているのが実情です。間質性肺炎合併肺癌患者の治療の際には、肺癌のみならず間質性肺炎自体を正しく評価する必要があります。
表4

◆間質性肺炎急性増悪の予防【ステートメント2025 第Ⅴ章-1.間質性肺炎急性増悪の予防】
1.間質性肺炎の急性増悪の予防で考えるべきこと
IPFを含むILDはときに急性増悪を生じることがあり、急性増悪を生じると急速に呼吸不全の進行をきたし予後不良であるとされています。本邦におけるレジストリー研究では、IPFの死因の40%は急性増悪であり3)、かつ発症後の生存中央値は3~4ヵ月とされています。また、近年ではIPF以外のILDにおいても線維化が進行する[進行性肺線維症(PPF)]とIPFと同様の転帰をたどることが明らかにされています15)。そのため、あらゆる進行性のILD症例では、急性増悪の予防としてまず考えるべき点は発症リスク因子や誘因を考慮し、回避することです。
2.急性増悪の誘因や発症リスクを考慮した予防策
急性増悪は、国際的に「Idiopathic(特発性)」と「Triggered(誘因性)」に分類されています16)。誘因としては、感染性や誤嚥、手術、全身麻酔、薬剤などがあげられ、これらの誘因に対する予防策が適切に講じられれば急性増悪を回避できる可能性があります。
急性増悪の発症リスク因子としては、呼吸機能、特に努力肺活量(FVC)の減少や肺拡散能(DLCO)の低下、低酸素血症、喫煙、感冒などがあげられます。
禁煙についても、慢性期の進行、急性増悪の予防への対策として重要です。低酸素血症への予防策としては、安静時および労作時に低酸素血症を認める症例は在宅酸素療法を考慮することとされています。
発症リスク因子を抽出し、それらの因子を用いて発症予測スコアを作成する研究も行われています。ILD診断時の3つの因子として抽出した蜂巣肺、年齢(75歳以上)、乳酸脱水素酵素(LDH)(222以上)それぞれを1点ずつ合計3点(HALスコア)とし、2点以上の症例が急性増悪を発症しやすい群として定義されました17)。該当する症例は、急性増悪発症により注意が必要です。
3.間質性肺炎合併肺癌に対する化学療法の急性増悪予防策
化学療法に起因するILDの急性増悪は、特にドライバー遺伝子変異に対する分子標的治療薬において過去に多数の薬剤起因性の急性肺障害を生じた経緯があり、かつ既存のILDを有した症例は高リスクとされていました。既存のILDや画像的に間質性変化を有する症例では慎重な判断が必要です。そのため、ほとんどの薬剤の添付文書では、ILDを有する症例では「慎重投与」の記載があり主治医に注意を促しています。その他、各薬剤、レジメンにおいて急性増悪、薬剤性肺障害発症率に関する調査が多く行われており、頻度が高い薬剤、レジメンを避けることで予防策としている場合が多くなっています。
◆間質性肺炎合併肺癌急性増悪の診断と増悪予測因子【ステートメント2025 第Ⅴ章-2.間質性肺炎急性増悪の診断と増悪予測因子】
1.間質性肺炎急性増悪の診断
a.IPFの急性増悪の診断基準
間質性肺炎のうち、IPFのみで急性増悪の診断基準が提唱されています。2004年に本邦において、また、2007年に国際的ワーキンググループによりそれぞれ診断基準が発表されています18)19)。
2016に発表された国際ワーキンググループによる診断基準案では、急性増悪は、①IPFの診断、②1ヵ月以内に出現もしくは悪化した呼吸困難、③CT上UIPパターンの背景に新たな両側性すりガラス影もしくはconsolidation、④心不全や輸液過剰では十分説明がつかない悪化、を満たすものとされました16)。この診断基準案において特記すべきは、感染、機械的ストレス、薬剤、誤嚥などの誘引がある場合の急性増悪をtriggered AEと名づけ、誘引のないidiopathic AEと区別しながらも、双方一括してIPFの急性増悪として定義した点です(図5)。これにより、抗癌薬治療や放射線治療、外科治療などの明確な引き金がある場合も、IPFの急性増悪として認識されることとなりました。
図5

b.非IPFの急性増悪の診断基準
非IPFを含めた間質性肺炎の急性増悪の診断基準に統一されたものは現状ありませんが、個別の研究ごとにIPFの急性増悪の診断基準を参考に診断が行われてきました。すなわち、IPFの診断基準の背景疾患をそれぞれの慢性間質性肺炎に置き換えて診断基準としているものが多く、実際の臨床現場においてもそのように扱われています。
2.間質性肺炎合併肺癌における間質性肺炎急性増悪の診断の実際
肺癌術後や抗癌薬治療、放射線治療の最中、もしくはのちにX線やCTにて新たなすりガラス影、consolidationの出現がある場合、心不全や輸液過剰によるものが除外されれば、急性増悪の可能性を考える必要があります。急性増悪以外の鑑別には、肺感染症、誤嚥、腫瘍や肺からの出血、癌性リンパ管症、無気肺などがあげられますが、これらについては症状、理学所見、高分解能CT(HRCT)20)、発症までの臨床経過、血液検査をもとに診断します21)。間質性肺炎の急性増悪は画像上、すりガラス影を呈することも多いため、ニューモシスチス肺炎やウイルス肺炎との鑑別が必要となり、β-D-グルカン、各種ウイルス抗原やPCR検査が有用なこともあります。また、必要に応じて、侵襲性があるが、気管支鏡検査や気管支肺胞洗浄を行うことも考慮されます。血清の間質性肺炎マーカー(KL-6、SP-D、SP-A)は、急性増悪時には上昇することが多いといわれていますが、急性増悪前の値が不明の場合には有用性が低下します。
2016年の診断基準案16)では、ひとたび肺感染症などの急性増悪以外の診断に至ったとしても、Triggered AEを同時発症または遅れて発症する点には留意が必要です。現状、急性増悪の診断は、総合的な臨床判断に基づいて行われます。
3.間質性肺炎の急性増悪の発症予測因子
IPF/間質性肺炎の急性増悪の発症予測因子としては複数の報告17)22)-38)があり、代表的なものは表5の通りに示されています。
また、間質性肺炎の急性増悪のうち抗癌薬が原因であるものに限定して、発症予測因子が報告されているものは表6の通りです39)-49)。
表5
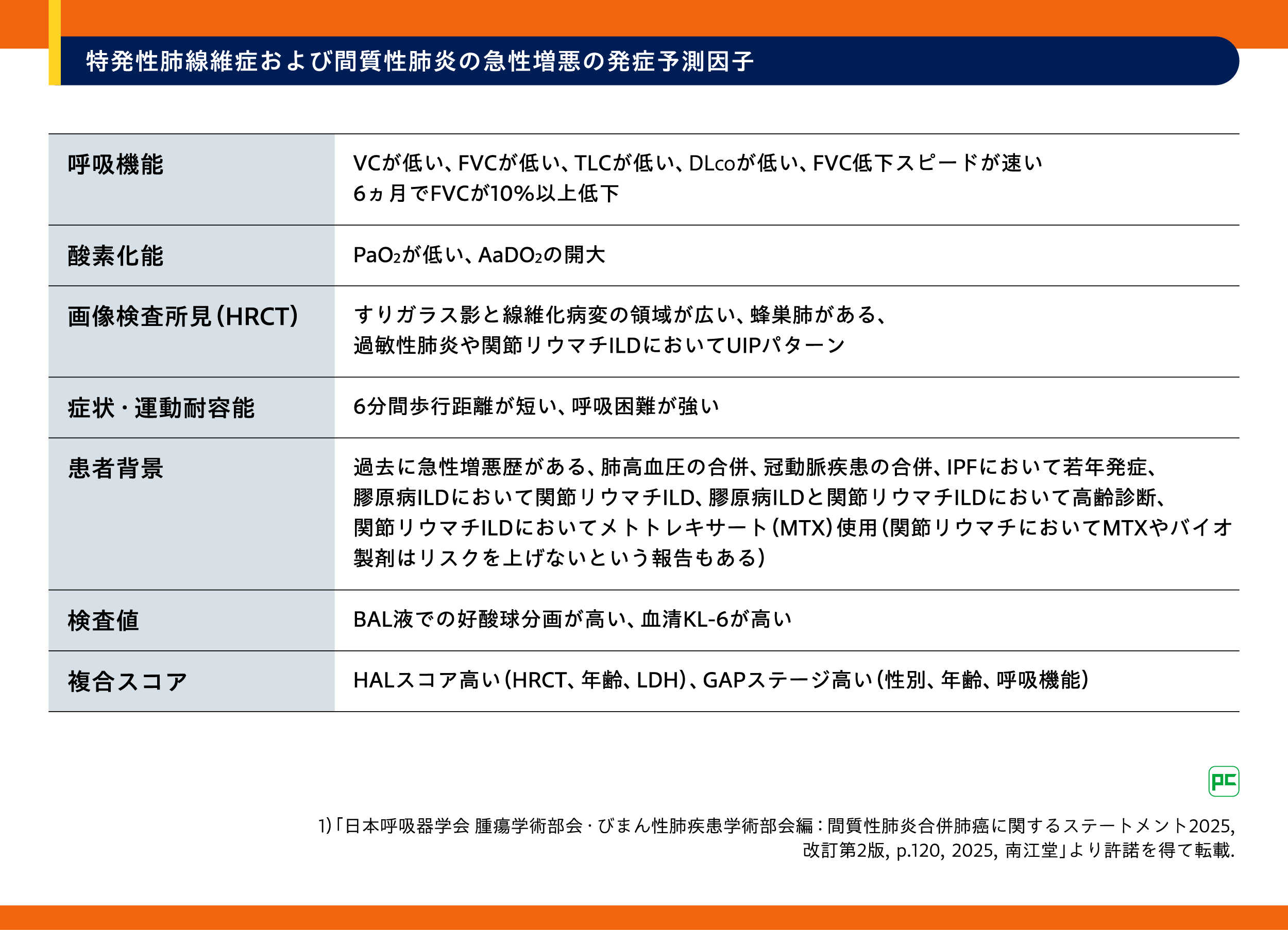
表6

◆オフェブのプロファイル
オフェブは本邦において、間質性肺疾患のうちIPF、全身性強皮症に伴う間質性肺疾患(SSc-ILD)、進行性線維化を伴う間質性肺疾患(PF-ILD)への適応が承認されています。したがって、間質性肺炎合併肺癌において線維化を呈し、IPFと診断した場合や、それ以外のILDであってもPF-ILDの基準を満たす場合は、治療選択肢の1つとして考慮される薬剤です。以下、オフェブの特徴や有効性、安全性についてご紹介します。
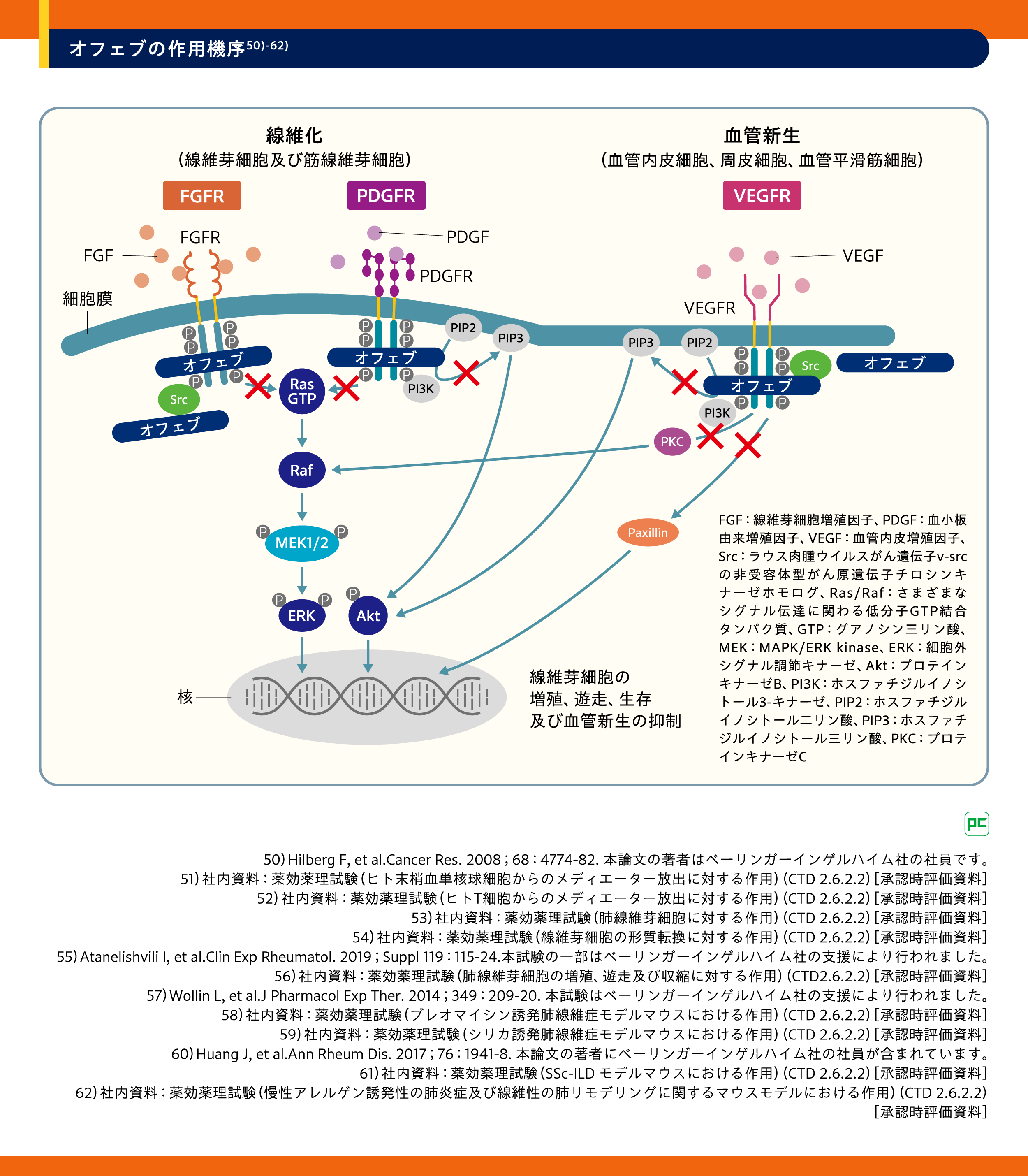
1.オフェブの作用機序50)-62)
オフェブは、血小板由来増殖因子受容体(PDGFR)α、β及び線維芽細胞増殖因子受容体(FGFR)1、2、3及び血管内皮増殖因子受容体(VEGFR)の各受容体においてアデノシン5′- 三リン酸(ATP)結合ポケットを占拠する低分子チロシンキナーゼ阻害剤であり、IPF、SSc-ILDおよびPF-ILDの発症に関与すると報告されているシグナル伝達を阻害します(図6)。
図6
2.INPULSIS試験63)-68)
今回は、オフェブのIPFにおける有効性の検証と安全性の検討を行った国際共同第III相試験INPULSIS試験(INPULSIS-1試験、INPULSIS-2試験及び両試験の併合解析)についてご紹介します(図7)。主要評価項目(検証的な解析項目)はFVCの年間減少率とされました。
その結果、FVCの年間減少率※1は、オフェブ群−113.6mL/年、プラセボ群−223.5mL/年であり、オフェブ群は、プラセボ群に対してFVCの年間減少率の低下を統計学的に有意に抑制しました(群間差:109.9mL/年、95%CI:75.9-144.0、p<0.0001)(検証的な解析結果)(図8)。
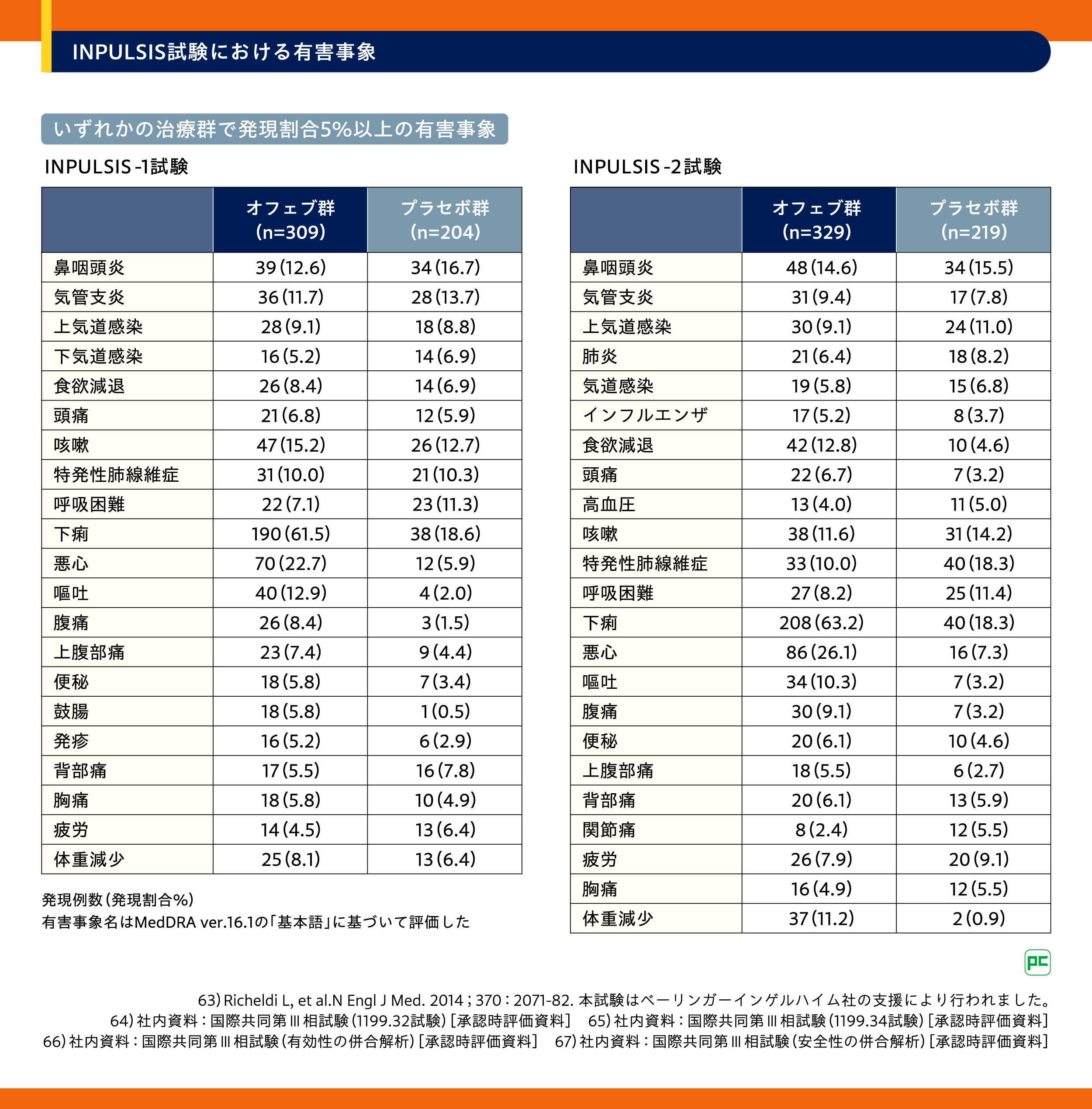
安全性については、INPULSIS-1試験における有害事象は、オフェブ群309例中298例(96.4%)、プラセボ群204例中181例(88.7%)に認められました。オフェブ群における重篤な有害事象※2は96例に認められ、主なもの(発現率2%以上)はIPF 20例(6.5%)でした。オフェブ群における投与中止に至った有害事象は65例に認められ、主なもの(発現率2%以上)は下痢14例(4.5%)、IPF、悪心が各7例(2.3%)でした。オフェブ群における死亡は12例に認められ、2例以上に認められた死因はIPF 7例、肺の悪性新生物2例でした。INPULSIS-2試験における有害事象は、オフェブ群329例中311例(94.5%)、プラセボ群219例中198例(90.4%)に認められました。オフェブ群における重篤な有害事象※2は98例に認められ、主なもの(発現率2%以上)はIPF 22例(6.7%)、肺炎18例(5.5%)でした。オフェブ群における投与中止に至った有害事象は58例に認められ、主なもの(発現率1%以上)は下痢14例(4.3%)、悪心、IPFが各6例(1.8%)、肺炎5例(1.5%)、食欲減退4例(1.2%)でした。オフェブ群における死亡は25例に認められ、2例以上に認められた死因はIPF 11例、肺炎5例、心筋梗塞、呼吸不全が各2例でしたが、いずれも試験薬との因果関係は否定されました。主な有害事象(いずれかの治療群で発現率5%以上の有害事象)を表7に示します。
※1:ランダム係数回帰モデルにより推定:投与群、性別、年齢、身長を固定効果(併合解析では試験を追加)、患者効果(切片と傾き)を変量効果としてランダム係数回帰モデルに含めた。
※2:1名を複数の重篤度分類基準でカウントしている場合がある。
図7

図8
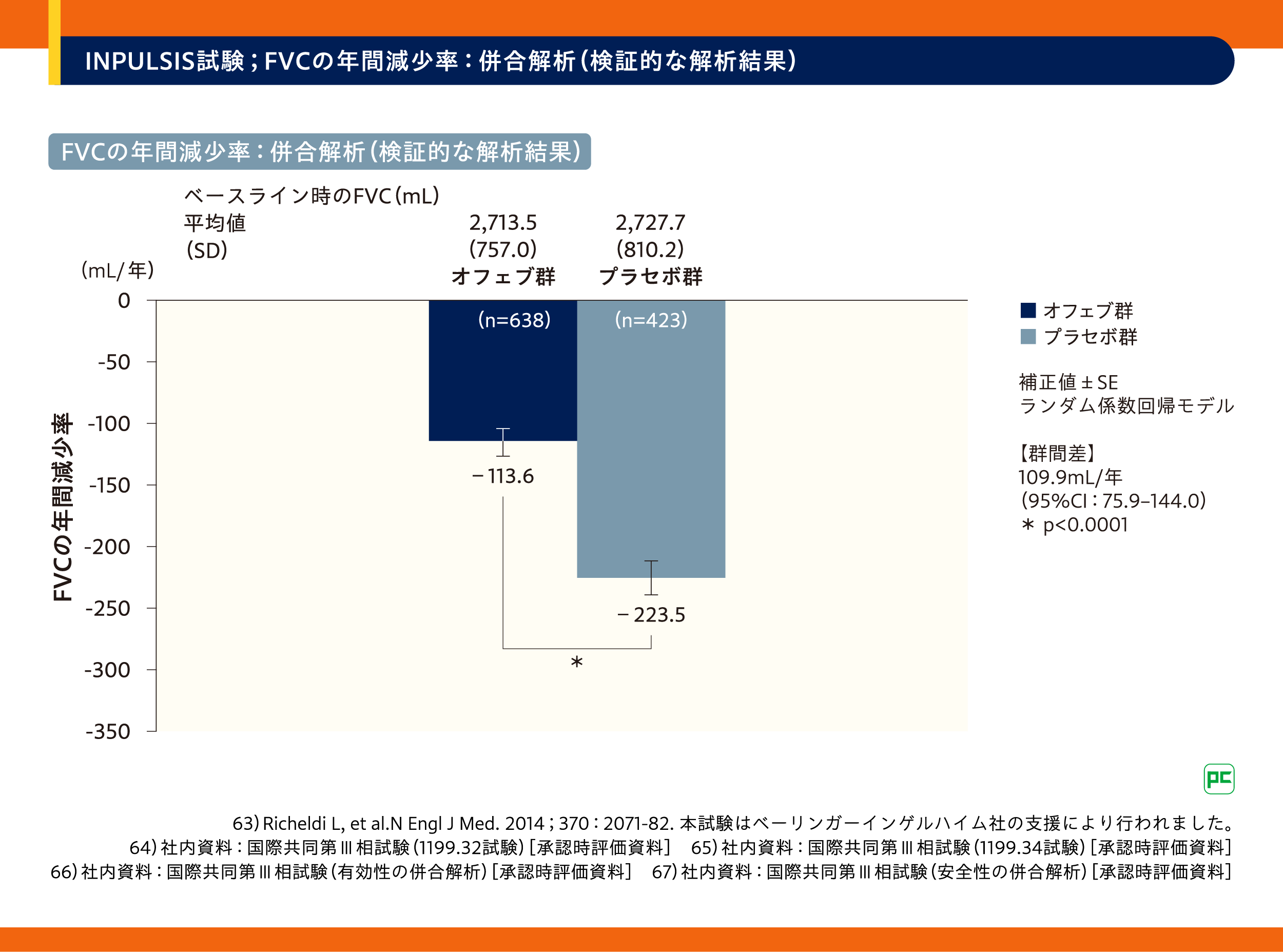
表7
今回ご紹介した内容を、間質性肺炎合併肺癌患者さんのご診療にお役立ていただけますと幸いです。
【参考文献】
- 日本呼吸器学会 腫瘍学術部会・びまん性肺疾患学術部会編. 間質性肺炎合併肺癌に関するステートメント2025 改訂第2版. 東京: 南江堂; 2025.
- 日本呼吸器学会 腫瘍学術部会・びまん性肺疾患学術部会編. 間質性肺炎合併肺癌に関するステートメント.東京: 南江堂; 2017.
- Natsuizaka M, et al. Am J Respir Crit Care Med. 2014; 190: 773-9.
- Chen R, et al. Clin Exp Med. 2023; 23: 2321-30.
- Howlader N, et al. N Engl J Med. 2020; 383: 640-9.
- Mizushima Y, et al. Chest. 1995; 108: 1272-7.
- Xiu W, et al. Cancer Med. 2023; 12: 11375-84.
- 日本呼吸器学会 びまん性肺疾患診断・治療ガイドライン作成委員会編.特発性間質性肺炎 診断と治療の手引き2022. 改訂第4版. 東京:南江堂;2022.
- Tzouvelekis A, et al. Lancet Respir Med. 2018; 6: 86-8. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Kato E, et al. ERJ Open Res. 2018; 4: 00111-2016.
- Liu Y, et al. Clin Respir J. 2018; 12: 1700-5.
- Lee KJ, et al. Thorac Cancer. 2012; 3: 150-5.
- Lee SH, et al. Ann Nucl Med. 2018; 32: 492-8.
- Jeon TY, et al. AJR Am J Roentgenol. 2010; 195: 370-6.
- Raghu G, et al. Am J Respir Crit Care Med. 2022; 205: E18-E47. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Collard HR, et al. Am J Respir Crit Care Med. 2016; 194: 265-75. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Karayama M, et al. Eur Respir J. 2023; 61: 2201634.
- 谷口博之, 他. 特発性肺線維症の急性増悪の新しい診断基準について. 厚生労働省科学研究費補助金難治性疾患克服研究事業びまん性肺疾患調査研究研究班平成15年度研究報告書. 2004; p.114-9.
- Collard HR, et al. Am J Respir Crit Care Med. 2007; 176: 636-43. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Akira M, et al. Am J Respir Crit Care Med. 2008; 178: 372-8.
- 日本呼吸器学会薬剤性肺障害の診断・治療の手引き第2版作成委員会編. 薬剤性肺障害の診断・治療の手引き. 第2版. 東京: メディカルレビュー社; 2018, p.12-46.
- Kondoh Y, et al. Respir Investig. 2015; 53: 271-8.
- Hirano C, et al. J Clin Med. 2019; 8: 2069.
- Song JW, et al. Eur Respir J. 2011; 37: 356-63.
- Kondoh Y, et al. Sarcoidosis Vasc Diffuse Lung Dis. 2010; 27: 103-10.
- Ohshimo S, et al. Respir Med. 2014; 108: 1031-9.
- Kang J, et al. Respir Res. 2021; 22: 152.
- Collard HR, et al. Respir Res. 2013; 14: 73. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Mura M, et al. Eur Respir J. 2012; 40: 101-9.
- Johannson KA, et al. Eur Respir J. 2014; 43: 1124-31.
- Schupp JC,et al. PLoS One. 2015; 10: e0116775. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Sugino K, et al. Sarcoidosis Vasc Diffuse Lung Dis. 2015; 32: 129-37.
- Judge EP, et al. Eur Respir J. 2012; 40: 93-100.
- Reichmann WM, et al. BMC Pulm Med. 2015; 15: 167. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Kawamura K, et al. BMC Pulm Med. 2019; 19: 113.
- Kakugawa T, et al. Respir Res. 2016; 17: 79.
- Huang TH, et al. BMC Pulm Med. 2021; 21: 165.
- Collard HR, et al. Eur Respir J. 2017; 49: 1601339. (本論文の著者はベーリンガーインゲルハイム社の社員です)
- Otsuka K, et al. Thorac Cancer. 2022; 13: 2978-84.
- Enomoto Y, et al. Lung Cancer. 2016; 96: 63-7.
- Koda K, et al. Ther Adv Chronic Dis. 2022; 13: 20406223221108395.
- Wang Z, et al. Front Oncol. 2023; 13: 1250688.
- Asai N, et al. Tumori. 2017; 103: 60-5.
- Kenmotsu H, et al. J Thorac Oncol. 2011; 6: 1242-6.
- Masuda T, et al. Cancer Chemother Pharmacol. 2018; 81: 131-9.
- Nishiyama N, et al. Int J Clin Oncol. 2020; 25: 282-91. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Akaike K, et al. Int J Clin Oncol. 2020; 25: 681-90.
- Shirasawa M, et al. BMC Cancer. 2019; 19: 163. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
- Ito N, et al. Anticancer Res. 2021; 41: 1497-506.
- Hilberg F, et al. Cancer Res. 2008; 68: 4774-82. (本論文の著者はベーリンガーインゲルハイム社の社員です)
- 社内資料:薬効薬理試験(ヒト末梢血単核球細胞からのメディエーター放出に対する作用)(CTD 2.6.2.2)[承認時評価資料]
- 社内資料:薬効薬理試験(ヒトT細胞からのメディエーター放出に対する作用)(CTD 2.6.2.2)[承認時評価資料]
- 社内資料:薬効薬理試験(肺線維芽細胞に対する作用)(CTD 2.6.2.2)[承認時評価資料]
- 社内資料:薬効薬理試験(線維芽細胞の形質転換に対する作用)(CTD 2.6.2.2)[承認時評価資料]
- Atanelishvili I, et al. Clin Exp Rheumatol. 2019; 37 Suppl 119: 115-24.(本試験の一部はベーリンガーインゲルハイム社の支援により行われました)
- 社内資料:薬効薬理試験(肺線維芽細胞の増殖、遊走及び収縮に対する作用)(CTD2.6.2.2)[承認時評価資料]
- Wollin L, et al. J Pharmacol Exp Ther. 2014; 349: 209-20. (本試験はベーリンガーインゲルハイム社の支援により行われました)
- 社内資料:薬効薬理試験(ブレオマイシン誘発肺線維症モデルマウスにおける作用)(CTD 2.6.2.2)[承認時評価資料]
- 社内資料:薬効薬理試験(シリカ誘発肺線維症モデルマウスにおける作用)(CTD 2.6.2.2)[承認時評価資料]
- Huang J, et al. Ann Rheum Dis. 2017; 76: 1941-8. (本論文の著者にベーリンガーインゲルハイム社の社員が含まれています)
- 社内資料:薬効薬理試験(SSc-ILD モデルマウスにおける作用)(CTD 2.6.2.2)[承認時評価資料]
- 社内資料:薬効薬理試験(慢性アレルゲン誘発性の肺炎症及び線維性の肺リモデリングに関するマウスモデルにおける作用)(CTD 2.6.2.2)[承認時評価資料]
- Richeldi L, et al. N Engl J Med 2014; 370: 2071-82. (本試験はベーリンガーインゲルハイム社の支援により行われました)
- 社内資料:国際共同第Ⅲ相試験(1199.32試験)[承認時評価資料]
- 社内資料:国際共同第Ⅲ相試験(1199.34試験)[承認時評価資料]
- 社内資料:国際共同第Ⅲ相試験(有効性の併合解析)[承認時評価資料]
- 社内資料:国際共同第Ⅲ相試験(安全性の併合解析)[承認時評価資料]
- Raghu G, et al. Am J Respir Crit Care Med 2011; 183: 788-824. (本論文の著者にベーリンガーインゲルハイム株式会社より謝礼等の支払いを受けている者が含まれています)
その他の関連情報


特発性肺線維症および進行性肺線維症 国際診療ガイドライン2022(静止画)
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。



