トラディアンス®配合錠AP/トラディアンス®配合錠BP
本剤は2型糖尿病に対し使用されている、選択的SGLT2阻害薬/胆汁排泄型選択的DPP-4阻害薬配合剤です。
クイックリンク
重要なお知らせ
このページは医療関係者の方向けに使いやすさを配慮した処方に関連する資料です。公式の電子添文が必要な場合には、ページ下部のボタンよりPDF形式でダウンロードしてください。
禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
製品の主な特徴
| 製品名 | トラディアンス®配合錠AP/トラディアンス®配合錠BP |
| 区分 | 処方箋医薬品注) |
| 適応症 | 2型糖尿病 |
| 有効成分 | エンパグリフロジン/リナグリプチン |
注)注意-医師等の処方箋により使用すること
製品の基本情報
組成
| 販売名 | トラディアンス配合錠AP | トラディアンス配合錠BP |
| 有効成分 | 1錠中エンパグリフロジン10mg、リナグリプチン 5mg | 1錠中エンパグリフロジン25mg、リナグリプチン 5mg |
| 添加剤 | D-マンニトール、部分アルファー化デンプン、トウモロコシデンプン、コポビドン、クロスポビドン、タルク、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、マクロゴール6000EP、黄色三二酸化鉄 | D-マンニトール、部分アルファー化デンプン、トウモロコシデンプン、コポビドン、クロスポビドン、タルク、ステアリン酸マグネシウム、ヒプロメロース、酸化チタン、マクロゴール6000EP、三二酸化鉄 |
製剤の性状
| 販売名 | トラディアンス配合錠AP | トラディアンス配合錠BP |
| 剤形 | 淡黄色のフィルムコート錠 | 淡赤色のフィルムコート錠 |
| 外形 | ||
| 垂線 | 約8.1mm | 約8.1mm |
| 厚さ | 約3.2mm | 約3.2mm |
| 重さ | 約185mg | 約185mg |
| 識別コード | 10/5 | 25/5 |
2型糖尿病
ただし、エンパグリフロジン及びリナグリプチンの併用による治療が適切と判断される場合に限る。
- 本剤を2型糖尿病治療の第一選択薬として用いないこと。
- トラディアンス配合錠AP(エンパグリフロジン/リナグリプチンとして10mg/5mg)については、原則として以下の場合に使用を検討すること。
- 既にエンパグリフロジン10mg及びリナグリプチン5mgを併用し状態が安定している場合
- エンパグリフロジン10mgの単剤治療により効果不十分な場合
- リナグリプチン5mgの単剤治療により効果不十分な場合
- トラディアンス配合錠BP(エンパグリフロジン/リナグリプチンとして25mg/5mg)については、原則として以下の場合に使用を検討すること。なお、特にエンパグリフロジン10mg及びリナグリプチン5mgの治療により効果不十分な場合に投与する際は、経過を十分に観察すること。
- 既にエンパグリフロジン25mg及びリナグリプチン5mgを併用し状態が安定している場合
- エンパグリフロジン10mg及びリナグリプチン5mgの治療により効果不十分な場合
- エンパグリフロジン25mgの単剤治療により効果不十分な場合
- 本剤は2型糖尿病と診断された患者に対してのみ使用し、1型糖尿病の患者には投与をしないこと。
- 本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行った上で効果が不十分な場合に限り考慮すること。
- 高度腎機能障害患者又は透析中の末期腎不全患者ではエンパグリフロジンの効果が期待できないため、投与しないこと。(「重要な基本的注意」、「腎機能障害患者」、「特定の背景を有する患者」の項参照)
- 中等度腎機能障害患者ではエンパグリフロジンの効果が十分に得られない可能性があるので投与の必要性を慎重に判断すること。(「重要な基本的注意」、「腎機能障害患者」、「特定の背景を有する患者」の項参照)
- 本剤投与中において、本剤の投与がエンパグリフロジン及びリナグリプチンの各単剤の併用よりも適切であるか慎重に判断すること。
通常、成人には1日1回1錠(エンパグリフロジン/リナグリプチンとして10mg/5mg又は25mg/5mg)を朝食前又は朝食後に経口投与する。
- 本剤の使用にあたっては、患者に対し低血糖症状及びその対処方法について十分説明すること。 (「合併症・既往歴等のある患者」、「重大な副作用」の項参照)
- 本剤投与中は、血糖を定期的に検査し、薬剤の効果を確かめ、本剤を3カ月投与しても効果が不十分な場合には他の治療法への変更を考慮すること。
- エンパグリフロジン投与により、血清クレアチニンの上昇又はeGFRの低下がみられることがあるので、腎機能を定期的に検査すること。腎機能障害患者においては経過を十分に観察し、継続的にeGFRが45mL/min/1.73m2未満に低下した場合は投与の中止を検討すること。(「効能又は効果に関連する注意 」、「腎機能障害患者」の項参照)
- エンパグリフロジン投与により、尿路感染及び性器感染を起こし、腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)、敗血症等の重篤な感染症に至ることがある。十分な観察を行うなど尿路感染及び性器感染の発症に注意し、発症した場合には適切な処置を行うとともに、状態に応じて休薬等を考慮すること。尿路感染及び性器感染の症状及びその対処方法について患者に説明すること。(「合併症・既往歴等のある患者」、「重大な副作用」の項参照)
- エンパグリフロジンの利尿作用により多尿・頻尿がみられることがある。また、体液量が減少することがあるので、適度な水分補給を行うよう指導し、観察を十分行うこと。脱水、血圧低下等の異常が認められた場合は、休薬や補液等の適切な処置を行うこと。特に体液量減少を起こしやすい患者(高齢者、腎機能障害患者、利尿薬併用患者等)においては、脱水や糖尿病性ケトアシドーシス、高浸透圧高血糖症候群、脳梗塞を含む血栓・塞栓症等の発現に注意すること。(「合併症・既往歴等のある患者」、「腎機能障害患者」、「高齢者」、「併用注意」、「重大な副作用」の項参照)
- エンパグリフロジンの作用機序である尿中グルコース排泄促進作用により、血糖コントロールが良好であっても脂肪酸代謝が亢進し、ケトーシスがあらわれ、ケトアシドーシスに至ることがある。
著しい血糖の上昇を伴わない場合があるため、以下の点に留意すること。
(1)悪心・嘔吐、食欲減退、腹痛、過度な口渇、倦怠感、呼吸困難、意識障害等の症状が認められた場合には、血中又は尿中ケトン体測定を含む検査を実施すること。異常が認められた場合には投与を中止し、適切な処置を行うこと。
(2)特に、インスリン分泌能の低下、インスリン製剤の減量や中止、過度な糖質摂取制限、食事摂取不良、感染症、脱水を伴う場合にはケトアシドーシスを発現しやすいので、観察を十分に行うこと。
(3)患者に対し、以下の点を指導すること。
- ケトアシドーシスの症状(悪心・嘔吐、食欲減退、腹痛、過度な口渇、倦怠感、呼吸困難、意識障害等)。
- ケトアシドーシスの症状が認められた場合には直ちに医療機関を受診すること。
- 血糖値が高値でなくともケトアシドーシスが発現しうること。
- エンパグリフロジンを含む SGLT2 阻害薬の投与中止後、血漿中半減期から予想されるより長く尿中グルコース排泄及びケトアシドーシスが持続した症例が報告されているため、必要に応じて尿糖を測定するなど観察を十分に行うこと。(「重大な副作用」の項参照)
- リナグリプチン投与により、急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。(「重大な副作用」の項参照)
- エンパグリフロジンは、尿中グルコース排泄促進作用を有する。排尿困難、無尿、乏尿あるいは尿閉の症状を呈する患者においては、その治療を優先するとともに他剤での治療を考慮すること。
- エンパグリフロジン投与による体重減少が報告されているため、過度の体重減少に注意すること。
- 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときは注意すること。(「重大な副作用」の項参照)
- 本剤と他の糖尿病用薬の併用における安全性は検討されていない。
- リナグリプチンとGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
合併症・既往歴等のある患者
- 低血糖を起こすおそれのある以下の患者又は状態
- 脱水を起こしやすい患者(血糖コントロールが極めて不良の患者、高齢者、利尿剤併用患者等)
エンパグリフロジンの利尿作用により脱水を起こすおそれがある。(「重要な基本的注意」、「併用注意」、「重大な副作用」の項参照) - 尿路感染、性器感染のある患者
症状を悪化させるおそれがある。(「重要な基本的注意」、「重大な副作用」の項参照) - 腹部手術の既往又はイレウスの既往のある患者
腸閉塞を含むイレウスを起こすおそれがある。(「重大な副作用」の項参照)
腎機能障害患者
- 高度腎機能障害患者又は透析中の末期腎不全患者
投与しないこと。エンパグリフロジンの効果が期待できない。(「効能又は効果に関連する注意 」、「重要な基本的注意」、「特定の背景を有する患者」の項参照) - 中等度腎機能障害患者
投与の必要性を慎重に判断すること。エンパグリフロジンの効果が十分に得られない可能性がある。(「効能又は効果に関連する注意 」、「重要な基本的注意」、「特定の背景を有する患者」の項参照)
肝機能障害患者
- 高度肝機能障害患者
有効性及び安全性を指標とした臨床試験は実施していない。(「特定の背景を有する患者」の項参照)
妊婦
妊婦又は妊娠している可能性のある女性には、本剤を投与せず、インスリン製剤等を使用すること。エンパグリフロジンの動物実験(ラット)で、ヒトの妊娠中期及び後期にあたる幼若動物への曝露により、腎盂及び尿細管の拡張が報告されている。また、動物実験(ラット)で胎児への移行が報告されている。リナグリプチンの動物実験(ラット及びウサギ)で、胎児への移行が報告されている。
授乳婦
授乳しないことが望ましい。エンパグリフロジン及びリナグリプチンの動物実験(ラット)で、乳汁中への移行が報告されている。
小児等
小児等を対象とした臨床試験は実施していない。
高齢者
一般に生理機能が低下し、脱水症状(口渇等)の認知が遅れるおそれがある。(「重要な基本的注意」、「重大な副作用」の項参照)
- 75歳以上の高齢者
エンパグリフロジンの国内外の臨床試験の併合解析において、75歳以上の患者では75歳未満の患者と比較し、エンパグリフロジン25mg群で体液量減少の有害事象の発現割合が高かった。(「重要な基本的注意」の項参照)
エンパグリフロジン
投与後血漿中には主に未変化体として存在する1)が、一部はUGT2B7、UGT1A3、UGT1A8及びUGT1A9によるグルクロン酸抱合により代謝される2)。(「代謝」の項参照)
リナグリプチン
主に糞中に未変化体のまま排泄される。尿中に排泄される割合は少量である。(「排泄」の項参照)
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
糖尿病用薬 スルホニルウレア剤 | 低血糖が起こるおそれがある。特に、スルホニルウレア剤又はインスリン製剤と併用する場合にはスルホニルウレア剤又はインスリン製剤の減量を検討すること。 | 血糖降下作用が増強される。 |
血糖降下作用を増強する薬剤 β遮断薬 | 血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が増強される。 |
| リトナビル (「薬物相互作用」の項参照) | リナグリプチンの代謝酵素であるCYP3A4阻害及び排泄に関与する P-gp阻害作用による。 | |
| 血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン等 | 血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が減弱される。 |
| リファンピシン (「薬物相互作用」の項参照) | リナグリプチンの代謝酵素であるCYP3A4誘導及び排泄に関与する P-gp誘導による。 | |
| 利尿薬 チアジド系薬剤 ループ利尿薬等 (「重要な基本的注意」、「合併症・既往歴等のある患者」、「重大な副作用」の項参照) | 必要に応じ利尿薬の用量を調整するなど注意すること。 | エンパグリフロジン:利尿作用が増強されるおそれがある。 |
| リチウム製剤 炭酸リチウム | リチウムの作用が減弱されるおそれがある。 | リチウムの腎排泄を促進することにより、血清リチウム濃度が低下する可能性がある。 |
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
- 低血糖(0.5%)
低血糖があらわれることがある。他のDPP-4阻害剤で、スルホニルウレア剤との併用で重篤な低血糖があらわれ、意識消失を来す例も報告されている。低血糖症状が認められた場合には、糖質を含む食品を摂取するなど適切な処置を行うこととし、α-グルコシダーゼ阻害薬との併用時にはブドウ糖を投与すること。(「重要な基本的注意」、「合併症・既往歴等のある患者」、「併用注意」、「有効性及び安全性に関する試験」の項参照) - 脱水(頻度不明)
口渇、多尿、頻尿、血圧低下等の症状があらわれ脱水が疑われる場合には、休薬や補液等の適切な処置を行うこと。脱水に引き続き脳梗塞を含む血栓・塞栓症等を発現した例が報告されている。(「重要な基本的注意」、「合併症・既往歴等のある患者」、「高齢者」、「併用注意」の項参照) - ケトアシドーシス(頻度不明)
ケトアシドーシス(糖尿病性ケトアシドーシスを含む)があらわれることがある。(「重要な基本的注意」の項参照) - 腎盂腎炎(頻度不明)、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)(頻度不明)、敗血症(頻度不明)
腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)があらわれ、敗血症(敗血症性ショックを含む)に至ることがある。(「重要な基本的注意」、「合併症・既往歴等のある患者」の項参照) - イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。(「合併症・既往歴等のある患者」の項参照) - 肝機能障害(0.2%)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。 - 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。 - 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。 - 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。(「重要な基本的注意」の項参照)
その他の副作用
| 1%以上 | 0.2~1%未満 | 頻度不明 | |
| 過敏症 | 血管性浮腫、じん麻疹、気管支収縮 | ||
| 感染症 | 尿路感染、膀胱炎、性器感染(外陰部腟炎、外陰部腟カンジダ症、亀頭炎等) | ||
| 代謝及び栄養障害 | 脂質異常症 | 体液量減少 | |
| 血液及びリンパ系障害 | 血液濃縮 | ||
| 神経障害 | めまい、味覚異常 | ||
| 呼吸器、胸郭及び縦隔障害 | 鼻咽頭炎、咳嗽 | ||
| 胃腸障害 | 便秘 | 鼓腸 | 腹部膨満、胃腸炎、口内炎 |
| 皮膚及び皮下組織障害 | 発疹 | そう痒症 | |
| 腎及び尿路障害 | 頻尿 | 多尿 | 尿量増加、排尿困難 |
| 生殖系障害 | 外陰腟そう痒症 | 陰部そう痒症、包茎 | |
| 一般・全身障害 | 口渇 | 空腹感、浮腫 | |
| 臨床検査 | 血中ケトン体陽性、膵酵素(血中アミラーゼ、リパーゼ)増加、尿中ケトン体陽性 | 体重減少、血中クレアチニン上昇 | 体重増加、糸球体濾過量減少、ヘマトクリット上昇 |
エンパグリフロジンの作用機序により、本剤服用中は尿糖陽性、血清1,5-AG(1,5-アンヒドログルシトール)低値を示す。尿糖及び血清1,5-AGの検査結果は、血糖コントロールの参考とはならないので注意すること。
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
非臨床試験に基づく情報
- エンパグリフロジンの雌雄マウスを用いた2年間反復投与がん原性試験(100、300及び1000mg/kg/日)において、1000mg/kg/日の雄で腎腫瘍の発生頻度の増加が認められた。
- 雌雄ラットを用いたエンパグリフロジンの2年間反復投与がん原性試験(100、300及び700mg/kg/日)において、300mg/kg/日以上の雄で精巣に間細胞腫、700mg/kg/日の雄で腸間膜リンパ節の血管腫の発生頻度の増加が認められた。
- マウスにエンパグリフロジン1000mg/kg/日(雄)及びラットにエンパグリフロジン300mg/kg/日(雄)を反復経口投与したときの曝露量(AUC0-24h)は、エンパグリフロジンの最大臨床推奨用量(1日1回25mg)のそれぞれ約33倍及び約19倍であった。
血中濃度
単回投与
健康成人を対象として、本剤又は単剤併用をクロスオーバー法により空腹時単回経口投与した。本剤(エンパグリフロジン/リナグリプチン10mg/5mg)と単剤併用(エンパグリフロジン10mgとリナグリプチン5mg)投与後(56例)、並びに本剤(エンパグリフロジン/リナグリプチン25mg/5mg)と単剤併用(エンパグリフロジン25mgとリナグリプチン5mg)投与後(42例)の血漿中濃度推移データを図1に、薬物動態パラメータを表1に示す。本剤の血漿中濃度推移及び薬物動態パラメータは、単剤併用時と類似しており、生物学的同等性の基準を満たす製剤であることが確認されている。3),4)(外国人データ)
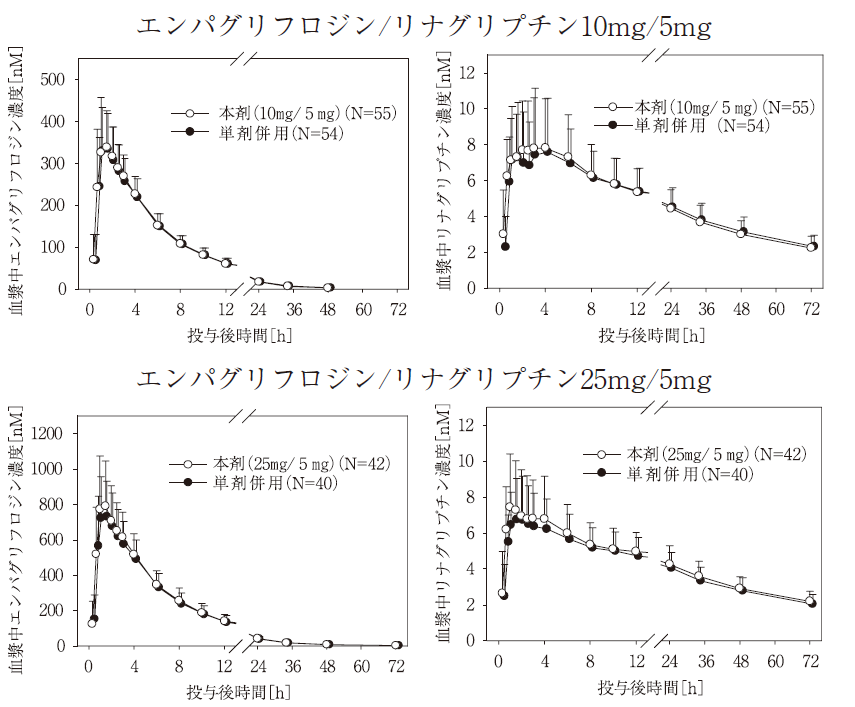
図1 健康成人に空腹時単回経口投与後の平均血漿中濃度推移(算術平均値+標準偏差)
表1 健康成人に空腹時単回経口投与後の血漿中薬物動態パラメータ
| パラメータ名 [単位] | エンパグリフロジン | リナグリプチン | ||
| 本剤 | 単剤併用 | 本剤 | 単剤併用 | |
| 10mg/5mg | N=55 | N=54 | N=55 | N=54 |
| AUC0-tz[nM・h] | 2590(17.5) | 2560(19.3) | 288(23.0) | 291(23.6) |
| Cmax[nM] | 380(24.6) | 374(22.4) | 9.92(36.6) | 9.35(42.7) |
| tmax[h] | 1.50 (0.667-4.00) | 1.02 (0.667-4.00) | 2.02 (0.333-6.03) | 2.00 (0.333-6.02) |
| t1/2[h] | 10.1(27.4) | 10.3(24.1) | 54.4(21.0) | 55.1(22.9) |
| 25mg/5mg | N=42 | N=40 | N=42 | N=40 |
| AUC0-tz[nM・h] | 6110(21.2) | 5840(20.5) | 271(22.1) | 256(21.7) |
| Cmax[nM] | 892(26.5) | 826(23.5) | 8.71(37.0) | 7.83(30.5) |
| tmax[h] | 1.50 (0.667-4.00) | 1.25 (0.667-3.98) | 1.50 (0.333-6.03) | 1.75 (0.667-10.0) |
| t1/2[h] | 14.0(35.6) | 13.7(37.4) | 55.3(18.7) | 56.0(26.6) |
算術平均値(変動係数%)、tmaxは中央値(最小値-最大値)
吸収
バイオアベイラビリティ
エンパグリフロジン
エンパグリフロジンの絶対バイオアベイラビリティの検討は行っていない。
リナグリプチン
健康成人男性に、リナグリプチン10mg注)を錠剤として経口投与したとき及び5mgを静脈内投与したとき(各10例)のデータを用いて絶対バイオアベイラビリティを算出した結果、約30%であった(母集団薬物動態解析による推定値)5)。(外国人データ)
食事の影響
日本人健康成人男性(22例)に、本剤(エンパグリフロジン/リナグリプチン25mg/5mg)を空腹時及び食後に単回経口投与したとき、Cmax及びAUC0-tzの幾何平均値の比(食後投与/空腹時投与)とその90%信頼区間は、エンパグリフロジンで74.9[66.3, 84.6]%及び86.0[83.4, 88.7]%、リナグリプチンで55.7[48.2, 64.3]%及び82.2[78.4, 86.2]%であった。空腹時投与に比べてtmaxの中央値はエンパグリフロジンで1.0時間、リナグリプチンで0.5時間延長した。6)
注)リナグリプチンの承認用量は5mgである。
分布
エンパグリフロジン
日本人2型糖尿病患者(腎機能正常、8例)にエンパグリフロジン25mgを単回経口投与したときのエンパグリフロジンの血漿蛋白結合率は84.7%であった7)。外国人健康成人男性(8例)に14C-エンパグリフロジン50mg注)溶液を経口投与したときの血球/血漿の放射能濃度の分布比は28.6~36.8%であった8)。
リナグリプチン
リナグリプチンのin vitro血漿蛋白結合率は濃度依存的であり、2nMでの98.8%から20nMでの84%へと減少した。30nM以上では蛋白結合率はほぼ一定であった9)。
注)エンパグリフロジンの承認用量は10mg及び25mgである。
代謝
エンパグリフロジン
- ヒト肝ミクロソーム及びヒト肝細胞では、エンパグリフロジンはほとんど代謝を受けなかった10)。主たる代謝物の生成にはUGT2B7、UGT1A3、UGT1A8及びUGT1A9が関与しており、CYP酵素の関与はほとんどなかった2),10)。
エンパグリフロジンはヒト肝ミクロソームのCYP1A2、2B6、2C8、2C9、2C19、2D6、3A4を阻害せず11),12)、CYP1A2、2B6、3A4を誘導しなかった13)。(in vitro データ) - 健康成人男性に14C-エンパグリフロジン50mg注)溶液を経口投与したとき(8例)、血漿中には主に未変化体が認められ(血漿中放射能に対する割合は75%超)、主な代謝物はグルクロン酸抱合体であった(血漿中放射能に対する割合は約3.3~7.4%)1)。(外国人データ)
リナグリプチン
- ヒト肝ミクロソーム及びヒト肝細胞での14C-リナグリプチンの代謝は極めて低い。主たる代謝物の生成にはCYP3A4のみが関与していた14)。リナグリプチンはヒト肝ミクロソームのCYP3A4活性を競合的に阻害するがその程度は弱く(Ki=115μM)、CYP1A1、1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1、4A11を阻害しなかった。また、ヒト肝ミクロソームのCYP3A4を弱~中程度に不可逆的に阻害した15)。CYP1A2、2B6、3A4を誘導しなかった16)。(in vitroデータ)
- 健康成人に14C-リナグリプチン10mg注)を経口投与したとき(6例)、血漿中には主に未変化体が認められ(血漿中放射能に対する割合は約62%)、主な代謝物はCYP3A4によって生成するピペリジニル基の水酸化体であった(血漿中放射能に対する割合は約5%)17)。(外国人データ)
注)エンパグリフロジンの承認用量は10mg及び25mgである。また、リナグリプチンの承認用量は5mgである。
排泄
エンパグリフロジン
- 日本人健康成人男性(各6例)にエンパグリフロジン10mg及び25mgを単回経口投与したときの投与後72時間までの尿中未変化体排泄率はそれぞれ投与量の21.3%及び22.9%であった18)。
- 健康成人男性(8例)に14C-エンパグリフロジン50mg注)溶液を単回経口投与したとき、投与放射能の約54.4%が尿中に、約41.2%が糞中に排泄された1)。(外国人データ)
- エンパグリフロジンはP-gp、BCRP、OAT3、OATP1B1及びOATP1B3の基質であった。また、エンパグリフロジンはBCRP、OAT3、OATP1B1及びOATP1B3に対して弱い阻害作用(IC50値: 各114、295、71.8、58.6μM)を示したが、P-gpに対して阻害作用を示さなかった。19)~21)(in vitroデータ)
リナグリプチン
- 日本人健康成人(6例)にリナグリプチン5mgを単回経口投与したときの投与24時間後までの尿中未変化体排泄率は約0.6%であった22)。
- 健康成人(6例)に14C-リナグリプチン10mg注)を単回経口投与したとき、投与後96時間までに投与放射能の約5%が尿中に、約80%が糞中に排泄された17)。(外国人データ)
- リナグリプチンはP-gpの基質であり、弱い阻害剤であった(IC50:約55μM)23)。(in vitro データ)
注)エンパグリフロジンの承認用量は10mg及び25mgである。また、リナグリプチンの承認用量は5mgである。
特定の背景を有する患者
腎機能障害患者
エンパグリフロジン
日本人腎機能正常(推定糸球体濾過量[eGFR]≥90mL/min/1.73m2、8例)及び軽度(eGFR 60~ <90mL/min/1.73m2、8例)、中等度(eGFR 30~<60mL/min/1.73m2、8例)、高度腎機能障害(eGFR 15~<30mL/ min/1.73m2、8例)の2型糖尿病患者にエンパグリフロジン25mg単回経口投与を行った。単回投与後の薬物動態パラメータの正常腎機能患者に対する幾何平均値の比とその90%信頼区間は、軽度、中等度、高度腎機能障害患者でそれぞれCmaxについて、93.5[72.2, 121]%、92.2[71.2, 119]%、94.0[72.6, 122]%であり、AUC0-∞について129[106, 157]%、144[118, 175]%、152[125, 185]%であった。投与後24時間までの尿中グルコース排泄量(UGE0-24h)のベースラインからの変化量の平均値は、腎機能正常患者で75.0g、軽度腎機能障害患者で62.6g、中等度腎機能障害患者で57.9g、高度腎機能障害患者で23.7gと腎機能の低下とともに減少した。7)
末期腎不全患者(8例)にエンパグリフロジン50mg注)単回経口投与を行った場合、Cmax及びAUC0-∞の正常腎機能患者(8例)に対する幾何平均値の比とその90%信頼区間は、104[81.2, 133]%及び148[120, 183]%であった。UGE0-24hのベースラインからの変化量の平均値は0.78gであった24)。(外国人データ)
リナグリプチン
健康被験者(クレアチニンクリアランス[Ccr]>80mL/min、6例)及び軽度(Ccr>50~≤80mL/min、6例)、中等度腎機能障害患者(Ccr>30~≤50mL/min、6例)にリナグリプチン5mg単回及び反復投与、並びに高度(Ccr≤30mL/min、6例)及び末期腎機能障害患者(Ccr≤30mL/minで血液透析が必要、6例)にリナグリプチン5mg単回投与を行った。単回投与後のAUC0-24hは健康被験者に比べて、軽度、中等度、高度、末期腎機能障害患者でそれぞれ約1.3倍、1.6倍、1.4倍、1.5倍であり、Cmaxはそれぞれ約1.3倍、1.6倍、1.5倍、1.5倍であった。反復投与後のAUCτ,ssは健康被験者に比べて、軽度及び中等度腎機能障害患者でそれぞれ約1.1倍及び1.7倍であり、Cmax,ssはそれぞれ約1.0倍及び1.5倍であった。腎機能正常(11例)及び高度腎機能障害を有する(10例)2型糖尿病患者にリナグリプチン5mg反復投与を行った。高度腎機能障害を有する2型糖尿病患者における反復投与後のAUCτ,ss及びCmax,ssは腎機能正常2型糖尿病患者に比べて、ともに約1.4倍であった。腎機能障害患者の累積係数は健康被験者と同程度であり、尿中排泄率は腎機能障害の程度によらず全群で低かった。25)(外国人データ)
肝機能障害患者
エンパグリフロジン
肝機能正常被験者(12例)及び軽度(Child-Pughスコア5又は6、8例)、中等度(Child-Pughスコア7~9、8例)、高度(Child-Pughスコア10~15、8例)肝機能障害者にエンパグリフロジン50mg注)単回経口投与を行った。単回投与後の薬物動態パラメータの肝機能正常被験者に対する幾何平均値の比とその90%信頼区間は、軽度、中等度及び高度肝機能障害者でそれぞれCmaxについて104[82.3, 131]%、123[97.7, 156]%、148[118, 187]%であり、AUC0-∞について123[98.9, 153]%、147[118, 183]%、 175[140, 218]%であった。26)(外国人データ)
リナグリプチン
健康被験者(8例)及び軽度(Child-Pughスコア6、8例)、中等度(Child-Pughスコア7~9、9例)、高度(Child-Pughスコア10~15、8例)肝機能障害患者にリナグリプチン5mg単回投与、並びに健康被験者及び軽度、中等度肝機能障害患者にリナグリプチン5mg1日1回7日間反復投与を行った。反復投与後のAUCτ,ssは健康被験者に比べて軽度及び中等度肝機能障害患者でそれぞれ約0.8倍及び0.9倍であり、Cmax,ssは約0.6倍及び0.9倍であった。また、高度肝機能障害患者のAUC0-24hは健康被験者に比べて1.0倍、Cmaxは0.8倍であった。
肝機能障害患者におけるリナグリプチンの曝露は健康被験者よりやや低く(最大36%:軽度肝機能障害患者のCmax,ss)、肝機能の低下に伴う曝露の増加はみられなかった。27)(外国人データ)
高齢者
エンパグリフロジン
2型糖尿病患者3208例(日本人患者628例を含む)を用いた母集団薬物動態解析の結果、年齢が50歳の場合に比べてエンパグリフロジンのAUCτ,ssは65歳では8.00%、75歳では12.5%高くなると予測された。28)
リナグリプチン
日本人2型糖尿病患者(159例)にリナグリプチン5mgを1日1回26週間投与したときのトラフ時の血漿中濃度の幾何平均値(幾何変動係数%)は65歳未満で6.57nM(31.1%)、65歳以上で7.66nM(26.9%)であった。29)
注)エンパグリフロジンの承認用量は10mg及び25mgである。
薬物相互作用
エンパグリフロジンとリナグリプチンの併用
健康成人男性(16例)にエンパグリフロジン50mg注)とリナグリプチン5mgを1日1回7日間反復併用投与した場合、エンパグリフロジン及びリナグリプチンの薬物動態への臨床的に問題となる影響はみられなかった。30)(外国人データ)
エンパグリフロジン
エンパグリフロジンの薬物動態に及ぼす併用薬の影響
メトホルミン31)、グリメピリド32)、ピオグリタゾン33),34)、シタグリプチン35)、ワルファリン36)、ベラパミル37)、ラミプリル37)、シンバスタチン38)、利尿薬(ヒドロクロロチアジド及びトラセミド)39)との併用によるエンパグリフロジンの薬物動態への臨床的に問題となる影響はみられなかった。ゲムフィブロジル40)、リファンピシン41)及びプロベネシド41)との併用投与によりエンパグリフロジンのAUCは59%、35%及び53%、Cmaxは15%、75%及び26%上昇した。これらの薬物動態の変化は臨床的に問題ないと考えられた。
併用薬の薬物動態に及ぼすエンパグリフロジンの影響
エンパグリフロジンの併用によるメトホルミン31)、グリメピリド32)、ピオグリタゾン33),34)、シタグリプチン35)、ワルファリン36)、ジゴキシン37)、ラミプリル37)、シンバスタチン38)、利尿薬(ヒドロクロロチアジド及びトラセミド)39)、経口避妊薬(エチニルエストラジオール及びレボノルゲストレル)42)の薬物動態への臨床的に問題となる影響はみられなかった。
リナグリプチン
リナグリプチンの薬物動態に及ぼす併用薬の影響
メトホルミン43)、ピオグリタゾン44)、グリベンクラミド45)との併用によるリナグリプチンの薬物動態への臨床的に問題となる影響はみられなかった。リトナビル46)及びリファンピシン47)との併用投与により、リナグリプチンのAUCは2倍上昇及び40%低下、Cmaxは3倍上昇及び44%低下した。
併用薬の薬物動態に及ぼすリナグリプチンの影響
リナグリプチンの併用によるシンバスタチン48)、メトホルミン43)、ピオグリタゾン44)、グリベンクラミド45)、ワルファリン49)、ジゴキシン50)、経口避妊薬(エチニルエストラジオール及びレボノルゲストレル)51)の薬物動態への臨床的に問題となる影響はみられなかった。
注)エンパグリフロジンの承認用量は10mg及び25mgである。
有効性及び安全性に関する試験
国内第Ⅲ相試験(リナグリプチン単剤で血糖コントロール不十分な2型糖尿病患者を対象とした本配合剤とリナグリプチン単剤の比較・検証試験)
食事・運動療法に加え、リナグリプチン5mg(L5)による単剤治療で血糖コントロールが不十分な日本人2型糖尿病患者を対象に、エンパグリフロジン10mg/リナグリプチン5mg配合錠(E10/L5配合錠)を1日1回24週間経口投与し、L5投与と比較した。HbA1c(主要評価項目:NGSP値)及び空腹時血糖の投与前値からの調整平均変化量は表2のとおりであった。
表2 24週時の結果
| HbA1c(NGSP値)(%) | 空腹時血糖値(mg/dl) | |||
| L5投与群 (N=93) | E10/L5配合錠 投与群 (N=182) | L5投与群 (N=93) | E10/L5配合錠 投与群 (N=182) | |
| 投与前値 | 8.36(0.08) | 8.27(0.05) | 178.39(3.43) | 177.25(2.57) |
| 24週時の投与前値からの変化量 | 0.21(0.09) | -0.93(0.06) | 4.34(2.81) | -35.84(1.79) |
| 対照群との差 [95%信頼区間] | ― | -1.14(0.11) [-1.36, -0.91]† | ― | -40.18(3.33) [-46.74, -33.62]† |
L5:リナグリプチン5mg、E10/L5:エンパグリフロジン10mg/リナグリプチン5mg
投与前値:平均値(SE)、投与前値からの変化量及び対照群との差:調整
平均変化量(SE)
†:P<0.0001
(MMRM:OC)
さらに24週投与時のHbA1c(NGSP値)が7.0%未満の患者には引き続きE10/L5配合錠を、7.0%以上の患者にはエンパグリフロジン25mg/リナグリプチン5mg配合錠(E25/L5配合錠)を28週目以降24週間継続投与し(計52週間)、L5投与と比較した。HbA1c及び空腹時血糖の投与前値からの調整平均変化量は表3のとおりであった。
表3 52週時の結果
| HbA1c(NGSP値)(%) | 空腹時血糖値(mg/dl) | |||
| L5投与群 (N=93) | 本配合錠投与群(E10/L5,E25/L5)注) (N=182) | L5投与群 (N=93) | 本配合錠投与群(E10/L5,E25/L5)注) (N=182) | |
| 投与前値 | 8.36(0.08) | 8.27(0.05) | 178.39(3.43) | 177.25(2.57) |
| 52週時の投与前値からの変化量 | 0.06(0.10) | -1.16(0.06) | 1.63(3.05) | -38.48(1.67) |
| 対照群との差 [95%信頼区間] | ― | -1.22(0.12) [-1.45, -0.99] | ― | -40.11(3.48) [-46.98, -33.25] |
L5:リナグリプチン5mg、E10/L5:エンパグリフロジン10mg/リナグリプチン5mg、E25/L5:エンパグリフロジン25mg/リナグリプチン5mg
投与前値:平均値(SE)、投与前値からの変化量及び対照群との差:調整平均変化量(SE)
注):投与28週時の増量の有無に関わらない集団(E10/L5を継続投与した患者及びE25/L5に増量して投与した患者)
(MMRM:OC)
なお、28週目以降にE25/L5配合錠に増量したE25/L5投与群(124例)における増量前[HbA1c(NGSP値)(SE):7.48%(0.04)]からのHbA1c変化量は-0.21%(0.03)であった。
低血糖の副作用発現割合は、本配合錠投与群1.1%(2/182例)、L5投与群1.1%(1/93例)であった。52)
国内第Ⅲ相試験(エンパグリフロジン10mg又は25mg単剤で血糖コントロール不十分な2型糖尿病患者を対象とした本配合剤とエンパグリフロジン単剤の比較・検証試験)
食事・運動療法に加え、エンパグリフロジン10mg(E10)又は25mg(E25)による単剤治療で血糖コントロールが不十分な日本人2型糖尿病患者を対象に、E10/L5配合錠又はE25/L5配合錠を1日1回24週間経口投与し、さらにE25/L5配合錠を投与した患者には引き続き計52週まで投与を継続し、それぞれE10、E25投与と比較した。HbA1c(主要評価項目(24週時):NGSP値)及び空腹時血糖の投与前値からの調整平均変化量は表4、表5のとおりであった。
低血糖の副作用はE25投与群の0.9%(1/116例)にみられ、E10投与群、E10/L5配合錠投与群、及びE25/L5配合錠投与群ではみられなかった。53)
表4 E10投与群とE10/L5配合錠投与群との比較
| HbA1c(NGSP値)(%) | 空腹時血糖値(mg/dl) | |||
| E10投与群 (N=108) | E10/L5配合錠 投与群 (N=107) | E10投与群 (N=108) | E10/L5配合錠 投与群 (N=107) | |
| 投与前値 | 8.40(0.07) | 8.34(0.05) | 159.04(2.31) | 159.25(2.53) |
| 24週時の投与前値からの変化量 | -0.12(0.06) | -0.94(0.05) | -2.09(1.87) | -14.38(1.81) |
| 対照群との差 [95%信頼区間] | ― | -0.82(0.08) [-0.97, -0.67]† | ― | -12.29(2.61) [-17.44, -7.15]† |
E10:エンパグリフロジン10mg、E10/L5:エンパグリフロジン10mg/リナグリプチン5mg
投与前値:平均値(SE)、投与前値からの変化量及び対照群との差:調整平均変化量(SE)
†:P<0.0001
(MMRM:OC)
表5 E25投与群とE25/L5配合錠投与群との比較
| HbA1c(NGSP値)(%) | 空腹時血糖値(mg/dl) | |||
| E25投与群 (N=116) | E25/L5配合錠 投与群 (N=116) | E25投与群 (N=116) | E25/L5配合錠 投与群 (N=116) | |
| 投与前値 | 8.26(0.06) | 8.27(0.05) | 149.11(1.95) | 151.78(2.09) |
| 24週時の投与前値からの変化量 | -0.33(0.05) | -0.91(0.05) | -4.05(1.71) | -9.45(1.69) |
| 対照群との差 [95%信頼区間] | ― | -0.59(0.07) [-0.73, -0.45]† | ― | -5.41(2.41) [-10.16, -0.65]‡ |
| 52週時の投与前値からの変化量 | -0.27(0.06) | -0.86(0.06) | -0.60(2.12) | -7.13(1.84) |
| 対照群との差 [95%信頼区間] | ― | -0.59(0.08) [-0.75, -0.42] | ― | -6.53(2.81) [-12.09, -0.97] |
E25:エンパグリフロジン25mg、E25/L5:エンパグリフロジン25mg/リナグリプチン5mg
投与前値:平均値(SE)、投与前値からの変化量及び対照群との差:調整平均変化量(SE)
†:P<0.0001、‡:P=0.0260
(MMRM:OC)
作用機序
エンパグリフロジン
腎臓で濾過されたグルコースは近位尿細管に存在するヒトナトリウム-グルコース共役輸送担体2(SGLT2)によってほぼ完全に再吸収され、わずかではあるがSGLT1によっても再吸収される54)。エンパグリフロジンはSGLT2選択的な競合阻害剤で、腎臓によるグルコースの再吸収を阻害することにより尿中グルコース排泄量を増加させ、血糖を低下させる55)。
リナグリプチン
リナグリプチンはジペプチジルペプチダーゼ-4(DPP-4)の競合的かつ可逆的な選択的阻害剤である。DPP-4は膜結合型プロテアーゼで、腎臓、肝臓、腸、リンパ球及び血管内皮細胞など多くの組織に広く発現しており、インクレチンと呼ばれるグルカゴン様ペプチド1(GLP-1)とグルコース依存性インスリン分泌刺激ポリペプチド(GIP)を分解し、不活性化する。リナグリプチンはDPP-4の活性を阻害することで、GLP-1とGIPレベルを上昇させ、これらインクレチンによる強力なグルコース依存性インスリン分泌刺激作用により、インスリン分泌が促進される56)。
さらに、GLP-1の作用によりグルカゴン放出も抑制される。この作用により食後の血糖コントロールを改善する。
薬理作用
エンパグリフロジンとリナグリプチンの併用時の血糖低下作用
Zucker糖尿病肥満(ZDF)ラットを用いた経口糖負荷試験において、エンパグリフロジンとリナグリプチンの単回併用投与により、いずれか単剤を投与した時に比べて血漿グルコース濃度上昇が抑制された57)。
エンパグリフロジン
SGLT2阻害作用
In vitro 試験で、エンパグリフロジンはSGLT2を選択的に阻害し(IC50:1.3nM)、ヒトSGLT1(IC50:6278nM)と比較して約5000倍の選択性を示した58)。
尿中グルコース排泄促進作用
糖尿病モデル動物(db/dbマウス及びZDFラット)において、エンパグリフロジンは単回経口投与により尿中グルコース排泄量(投与後7時間)を増加させた55)。
日本人2型糖尿病患者にエンパグリフロジン1mg、5mg、10mg、25mg又はプラセボを1日1回4週間反復経口投与した。エンパグリフロジンはプラセボに比べ投与28日目の投与24時間後までの累積尿中グルコース排泄量を増加させた59)。
血糖低下作用
糖尿病モデル動物(db/dbマウス及びZDFラット)において、エンパグリフロジンは単回経口投与により血糖低下作用を示した55)。さらに、ZDFラットにおいて、エンパグリフロジンは1日1回5週間反復経口投与により、投与22日目(摂食下)及び投与37日目(絶食下)の血中グルコース濃度並びにHbA1cを低下させた60)。
日本人2型糖尿病患者にプラセボ、エンパグリフロジン10mg又は25mgを1日1回24週間反復経口投与した。エンパグリフロジンはプラセボに比べHbA1cを低下させた61)。
リナグリプチン
DPP-4阻害作用
リナグリプチンは、in vitro において、ヒトDPP-4(血漿、Caco-2細胞由来)の活性を選択的に阻害する(IC50値: 1~3.6nM)62)。リナグリプチンの血漿中のDPP-4活性に対する阻害作用(80%以上)は、その薬物動態特性により、24時間持続する22)。
耐糖能及び糖代謝改善作用
リナグリプチンは正常動物(マウス及びラット)において、GLP-1とインスリンの分泌を増大し、グルコース負荷試験による血糖値上昇を有意に抑制した62)。さらに、2型糖尿病を示す数種のモデル動物(db/dbマウス、肥満Zucker Fattyラット、ZDFラット)においても、グルコース負荷試験による血糖値上昇を有意に抑制した62)。重度のインスリン抵抗性を持つdb/dbマウスにおいて、HbA1cを有意に低下させた63)。
日本人の2型糖尿病患者において、リナグリプチンは血中GLP-1濃度を増加させ、血糖値を低下させた64)。
エンパグリフロジン
一般的名称:エンパグリフロジン(Empagliflozin)(JAN,INN)
化学名:(1S)-1,5-Anhydro-1-C -{4-chloro-3-[(4-{[(3S)-oxolan-3-yl]oxy}phenyl)methyl]phenyl}-D-glucitol
分子式 :C23H27ClO7
分子量 :450.91
性状:白色から黄白色の粉末である。メタノールにやや溶けにくく、エタノール(99.5)に溶けにくく、水に極めて溶けにくい。
化学構造式:
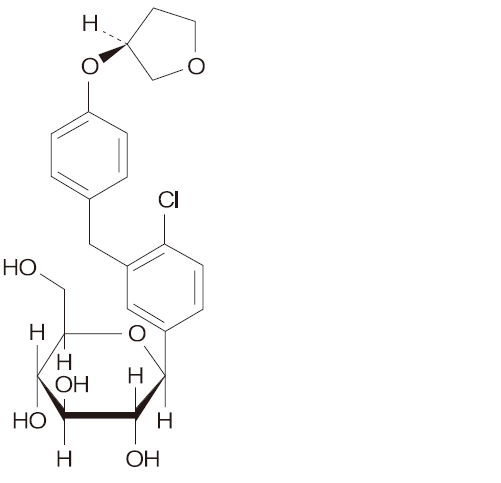
融点 :150℃±2℃
分配係数:logD(pH7.4)=logP=1.7
リナグリプチン
一般的名称:リナグリプチン(Linagliptin)(JAN,INN)
化学名:8-[(3R)-3-aminopiperidin-1-yl]-7-(but-2-yn-1-yl)-3-methyl-1[(4-methylquinazolin-2-yl)methyl]-3,7-dihydro-1H-purine-2,6-dione
分子式:C25H28N8O2
分子量:472.54
性状:白色~帯黄白色の粉末である。エタノール(99.5)にやや溶けにくく、水に極めて溶けにくい。
化学構造式:
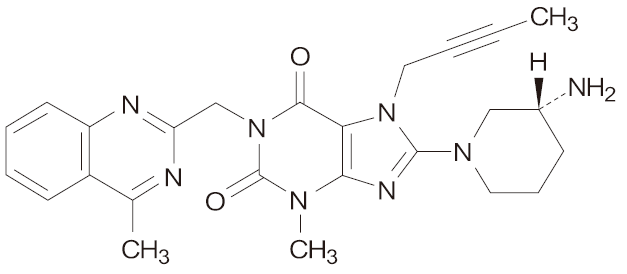
融点:202~209℃
分配係数:logD=0.4(pH7.4)
〈トラディアンス配合錠AP〉
100錠[10錠(PTP)×10]
〈トラディアンス配合錠BP〉
100錠[10錠(PTP)×10]
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:エンパグリフロジン/リナグリプチン配合剤の生物学的同等性試験(2018年9月21日承認、CTD 2.7.1.4、2.7.6.1)
- 社内資料:エンパグリフロジン/リナグリプチン配合剤の薬物動態試験(2018年9月21日承認、CTD 2.7.6.1)
- Retlich S. et al.:Clin Pharmacokinet. 2010;49(12):829-840
- 遅野井 健ほか:Jpn Pharmacol Ther. 2018;46(3):343-353
- 社内資料:日本人2型糖尿病患者を対象としたエンパグリフロジンの腎機能障害試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:エンパグリフロジンのヒトADME試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:リナグリプチン非臨床薬物動態試験(血漿蛋白結合)(2011年7月1日承認、CTD 2.6.4.4)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.5)
- 社内資料:リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
- 社内資料:リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.7.2.3)
- 社内資料 リナグリプチン非臨床薬物動態試験(代謝)(2011年7月1日承認、CTD 2.6.4.5)
- 社内資料:健康成人を対象としたリナグリプチンの14C標識体単回投与試験(2011年7月1日承認、CTD 2.7.6.2)
- Sarashina A. et al.:Drug Metab. Pharmacokinet. 2013;28(3):213-219
- 社内資料:エンパグリフロジン非臨床薬物動態試験(代謝)(2014年12月26日承認、CTD 2.6.4.4)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(トランスポーター)(2014年12月26日承認、CTD 2.6.4.4)
- 社内資料:エンパグリフロジン非臨床薬物動態試験(トランスポーター)(2014年12月26日承認、CTD 2.6.4.4)
- 社内資料:健康成人を対象としたリナグリプチンの単回及び反復投与試験(2011年7月1日承認、CTD 2.7.6.2)
- 社内資料:リナグリプチン非臨床薬物動態試験(トランスポーター)(2011年7月1日承認、CTD 2.6.4.4)
- Macha S. et al.:Diabetes Obes. Metab. 2014;16(3):215-222
- Graefe-Mody U. et al.:Diabetes Obes Metab. 2011;13(10):939-946
- Macha S. et al.:Diabetes Obes. Metab. 2014;16(2):118-123
- Graefe-Mody U. et al.:Br J Clin Pharmacol. 2012;74(1):75-85
- 社内資料:エンパグリフロジンの2型糖尿病患者母集団薬物動態解析(2014年12月26日承認、CTD 2.7.2.2)
- 社内資料:リナグリプチンの検証試験(2011年7月1日承認、CTD 2.7.6.4)
- Friedrich C. et al.:Clin. Ther. 2013;35(1):A33-A42
- Macha S. et al.:Int. J. Clin. Pharmacol. Ther. 2013;51(2):132-140
- Macha S. et al.:J Diabetes Res. Clin. Metab. 2012;1:14
- 社内資料:エンパグリフロジンとピオグリタゾンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:エンパグリフロジンとピオグリタゾンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- Brand T. et al.:Adv. Ther. 2012;29(10):889-899
- Macha S. et al.:Diabetes Obes. Metab. 2013;15(4):316-323
- Macha S. et al.:Clin. Ther. 2013;35(3):226-235
- 社内資料:エンパグリフロジンとシンバスタチンとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:エンパグリフロジンと利尿薬(ヒドロクロロチアジド及びトラセミド)との薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:エンパグリフロジンとゲムフィブロジルとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- 社内資料:エンパグリフロジンとリファンピシン及びプロベネシドとの薬物相互作用試験(2014年12月26日承認、CTD 2.7.6.2)
- Macha S. et al.:Clin. Drug. Invest. 2013;33(5):351-357
- Graefe-Mody EU. et al.:Curr Med Res Opin. 2009;25(8):1963-1972
- Graefe-Mody EU. et al.:Int J Clin Pharmacol Ther. 2010;48(10):652-661
- Graefe-Mody U. et al.:Drug Metab Pharmacokinet. 2011;26(2):123-129
- 社内資料:リナグリプチンとリトナビルとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
- 社内資料:リナグリプチンとリファンピシンとの薬物相互作用試験(2011年7月1日承認、CTD 2.7.2.2)
- Graefe-Mody U. et al.:Int J Clin Pharmacol Ther. 2010;48(6):367-374
- Graefe-Mody EU. et al.:Int J Clin Pharmacol Ther. 2011;49(5):300-310
- Friedrich C. et al.:Eur J Drug Metab Pharmacokinet. 2011;36(1):17-24
- Friedrich C. et al.:Clin Drug Investig. 2011;31(9):643-653
- 社内資料:エンパグリフロジン/リナグリプチン配合剤国内第Ⅲ相比較・検証試験(2018年9月21日承認、CTD 2.7.6.3)
- 社内資料:エンパグリフロジン/リナグリプチン配合剤国内第Ⅲ相比較・検証試験(2018年9月21日承認、CTD 2.7.6.3)
- Gerich JE.:Diabetic Med.:2010;27:136-142
- 社内資料:エンパグリフロジン非臨床薬効薬理試験(in vivo 単回)(2014年12月26日承認、CTD 2.6.2.2)
- Rauch T. et al.:Diabetes Ther. 2012;3(1):10
- 社内資料:非臨床薬効薬理試験(in vivo 併用時)(2018年9月21日承認、CTD 2.6.2.2)
- 社内資料:エンパグリフロジン非臨床薬効薬理試験(in vitro)(2014年12月26日承認、CTD 2.6.2.2)
- 社内資料:エンパグリフロジンの日本人2型糖尿病患者を対象とした4週間反復投与試験(2014年12月26日承認、CTD 2.7.6.3)
- 社内資料:エンパグリフロジン非臨床薬効薬理試験(in vivo 反復)(2014年12月26日承認、CTD 2.6.2.2)
- 社内資料:エンパグリフロジンの日本人2型糖尿病患者を含む国際共同第Ⅲ相24週投与試験(2014年12月26日承認、CTD 2.7.6.4)
- 社内資料:リナグリプチン非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
- 社内資料:リナグリプチン非臨床薬効薬理試験(2011年7月1日承認、CTD 2.6.2.2)
- Horie Y. et al.:Clin Ther. 2011;33(7):973-989


