スピオルト®レスピマット®28吸入/スピオルト®レスピマット®60吸入
本剤はCOPD(慢性気管支炎、肺気腫)に対し使用される、長時間作用性吸入配合剤です。
重要なお知らせ
公式の電子添文が必要な場合には、ページ下部のボタンよりPDF形式でダウンロードしてください。
禁忌(次の患者には投与しないこと)
- 閉塞隅角緑内障の患者
[眼内圧を高め、症状を悪化させるおそれがある。][「重要な基本的注意」、「副作用の項の閉塞隅角緑内障(頻度不明)」の項参照] - 前立腺肥大等による排尿障害のある患者
[更に尿を出にくくすることがある。][「特定の背景を有する患者に関する注意の項の前立腺肥大(排尿障害がある場合を除く)のある患者」の項参照] - アトロピン及びその類縁物質あるいは本剤の成分に対して過敏症の既往歴のある患者
製品の主な特徴
| 製品名 | スピオルト®レスピマット®28吸入/スピオルト® レスピマット®60吸入 |
| 区分 | 処方箋医薬品 |
| 適応症 | 慢性閉塞性肺疾患(慢性気管支炎、肺気腫)の気道閉塞性障害に基づく諸症状の緩解(長時間作用性吸入抗コリン剤及び長時間作用性吸入β2刺激剤の併用が必要な場合) |
| 有効成分 | チオトロピウム臭化物水和物/オロダテロール塩酸塩 |
製品の基本情報
組成
| 販売名 | スピオルト レスピマット28吸入 | スピオルト レスピマット60吸入 |
| 有効成分 | 1噴霧中チオトロピウム 2.5μg(チオトロピウム臭化物水和物として3.124μg)及びオロダテロール 2.5μg (オロダテロール塩酸塩として2.736μg) | |
| 添加剤 | ベンザルコニウム塩化物、エデト酸ナトリウム水和物、精製水、塩酸 | |
製剤の性状
| 販売名 | スピオルト レスピマット28吸入 | スピオルト レスピマット60吸入 |
| 内容物 | カートリッジの内容物は無色澄明の液である。 | |
慢性閉塞性肺疾患(慢性気管支炎、肺気腫)の気道閉塞性障害に基づく諸症状の緩解(長時間作用性吸入抗コリン剤及び長時間作用性吸入β2刺激剤の併用が必要な場合)
本剤は慢性閉塞性肺疾患(COPD:慢性気管支炎、肺気腫)の維持療法に用いること。本剤は急性症状の軽減を目的とした薬剤ではない。
本剤は気管支喘息治療を目的とした薬剤ではないため、気管支喘息治療の目的には使用しないこと。
通常、成人には1回2吸入(チオトロピウムとして5μg及びオロダテロールとして5μg)を1日1回吸入投与する。
本剤を他の長時間作用性抗コリン薬、長時間作用性β₂刺激薬又はこれらを含む配合剤と同時に使用しないこと。[「その他の注意の項の臨床使用に基づく情報」の項参照]
用法及び用量どおり正しく使用しても効果が認められない場合には、本剤が適当ではないと考えられるので、漫然と投与を継続せず中止すること。
急性症状を緩和するためには、短時間作用性吸入β₂刺激薬等の他の適切な薬剤を使用するよう患者に注意を与えること。
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、疾患の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者に注意を与えること。
本剤の投与中に短時間作用性吸入β₂刺激薬を使用する場合は、急性の気管支痙攣等、急性呼吸器症状の緩和のみに使用するよう患者に注意を与えること。
吸入薬の場合、薬剤の吸入により気管支痙攣が誘発される可能性があるので、異常が認められた場合には、投与を中止し、適切な処置を行うこと。
本剤の投与時に、本剤が眼に入らないように患者に注意を与えること。また、結膜の充血及び角膜浮腫に伴う赤色眼とともに眼痛、眼の不快感、霧視、視覚暈輪あるいは虹輪が発現した場合、急性閉塞隅角緑内障の徴候の可能性がある。これらの症状が発現した場合には、可及的速やかに医療機関を受診するように患者に注意を与えること。[「禁忌の項の閉塞隅角緑内障の患者」、「副作用の項の閉塞隅角緑内障(頻度不明)」の項参照]
過度に使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、使用が過度にならないよう注意すること。また、患者に対し、本剤の過度の使用による危険性があることを理解させ、1日1回、できるだけ同じ時間帯に吸入し、1日1回を超えて投与しないよう注意を与えること。[「過量投与の項の症状」、「薬物動態の項の心電図への影響」、「臨床成績の項のその他」の項参照]
合併症・既往歴等のある患者
- 心不全、心房細動、期外収縮の患者、又はそれらの既往歴のある患者
心不全、心房細動、期外収縮が発現することがある。[「副作用の項の心不全(頻度不明)、心房細動(1%未満)、期外収縮(1%未満)」の項参照] - 心血管障害(冠不全、不整脈、肥大型閉塞性心筋症)のある患者
交感神経刺激作用により症状を悪化させるおそれがある。また、QT延長があらわれるおそれがある。 - 高血圧の患者
血圧を上昇させるおそれがある。 - 痙攣性疾患のある患者
痙攣の症状を悪化させるおそれがある。 - 糖尿病の患者
高用量のβ2刺激薬を投与すると、血糖値が上昇するおそれがある。 - 甲状腺機能亢進症の患者
甲状腺機能亢進症の症状を悪化させるおそれがある。 - 前立腺肥大(排尿障害がある場合を除く)のある患者
排尿障害が発現するおそれがある。[「禁忌の項の前立腺肥大等による排尿障害のある患者」の項参照] - 気管支喘息を合併した患者
気管支喘息の治療が適切に行われるよう注意すること。
腎機能障害患者
- 腎機能が高度あるいは中等度低下している患者(クレアチニンクリアランス値が50mL/min以下の患者)
血中濃度の上昇がみられる。チオトロピウムは腎排泄型である。[「薬物動態の項の排泄」、「薬物動態の項の腎機能低下患者」の項参照]
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。高用量オロダテロール(2489μg/kg/日)の妊娠ウサギへの吸入投与により、その胎児に骨格、眼及び心血管の発生異常が報告されている。チオトロピウム及びオロダテロールいずれも、動物実験(ラット)で胎児に移行することが認められている。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。チオトロピウム及びオロダテロールいずれも、動物実験(ラット)で乳汁中に移行することが認められている。
小児等
小児等を対象とした臨床試験は実施していない。
高齢者
副作用の発現に注意すること。一般に腎クリアランス等の生理機能が低下しており、血中濃度が上昇するおそれがある。[「薬物動態の項の高齢者」の項参照]
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
QT間隔延長を起こすことが知られている薬剤 MAO阻害剤 三環系抗うつ剤等 | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
| 交感神経刺激剤 | オロダテロールの交感神経刺激作用が増強され、心拍数増加、血圧上昇等がみられるおそれがある。 | 交感神経刺激剤との併用により、アドレナリン作動性神経刺激が増大する可能性がある。 |
| キサンチン誘導体 ステロイド剤 非カリウム保持性利尿剤 | 低カリウム血症による心血管事象を起こすおそれがあるため、血清カリウム値に注意すること。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下が増強する可能性がある。 ステロイド剤及びこれらの利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強する可能性がある。 |
| β遮断剤 | オロダテロールの作用が減弱するおそれがある。やむを得ず併用する場合には、心選択性β遮断剤が望ましいが、注意すること。 | β遮断剤との併用により、オロダテロールの作用が拮抗される可能性がある。 |
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
- 心不全(頻度不明)、心房細動(1%未満)、期外収縮(1%未満)[「特定の背景を有する患者に関する注意の項の心不全、心房細動、期外収縮の患者、又はそれらの既往歴のある患者」の項参照]
- イレウス(頻度不明)
- 閉塞隅角緑内障(頻度不明)
視力低下、眼痛、頭痛、眼の充血等があらわれた場合には投与を中止し、適切な処置を行うこと。[「禁忌の項の閉塞隅角緑内障の患者」、「重要な基本的注意」の項参照] - アナフィラキシー(頻度不明)
アナフィラキシー(じん麻疹、血管浮腫、呼吸困難等)が発現することがある。
その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 眼 | 霧視 | 眼圧上昇 | |
| 皮膚 | そう痒、じん麻疹、脱毛 | 発疹、皮膚感染、皮膚潰瘍、皮膚乾燥 | |
| 中枢神経系 | 浮動性めまい、不眠 | ||
| 感覚器 | 味覚倒錯 | 嗅覚錯誤 | |
| 消化器 | 口渇(1.3%) | 便秘 | 消化不良、口内炎、舌炎、嚥下障害、胃食道逆流性疾患、歯肉炎 |
| 代謝 | 高尿酸血症 | 脱水 | |
| 循環器 | 動悸、頻脈、上室性頻脈、高血圧 | ||
| 血液 | 好酸球増多、白血球減少 | ||
| 呼吸器 | 発声障害、咳嗽、鼻出血、咽頭炎、鼻咽頭炎、喉頭炎、中咽頭カンジダ症、咽喉刺激感、呼吸困難 | 喘鳴、副鼻腔炎、気管支痙攣 | |
| 泌尿器 | 排尿障害、尿閉 | 血尿、夜間頻尿、クレアチニン上昇、腎機能異常、尿路感染 | |
| 筋骨格系 | 関節痛、背部痛 | 関節腫脹 | |
| 一般的全身障害 | 過敏症(血管浮腫を含む) |
症状
本剤を高用量投与した場合、抗コリン作動薬の徴候及び症状(口渇、動悸、排尿困難等)並びにβ₂刺激薬の徴候及び症状(心筋虚血、高血圧、低血圧、頻脈、不整脈、頭痛、振戦、口渇、筋痙攣、悪心、疲労、倦怠、低カリウム血症、高血糖、代謝性アシドーシス等)が発現する可能性がある。[「重要な基本的注意」、「薬物動態の項の心電図への影響」、「臨床成績のその他」の項参照]
処置
心選択性β遮断剤を使用する際は、気管支痙攣を誘発する可能性があるため、使用にあたっては十分に注意すること。
薬剤交付時の注意
患者には専用の吸入用器具レスピマット®及び使用説明書を渡し、使用方法を指導すること。
臨床使用に基づく情報
本剤と短時間作用型抗コリン性気管支拡張剤(イプラトロピウム臭化物水和物、オキシトロピウム臭化物等)との併用に関しては、臨床試験成績はなく、併用による有効性及び安全性は確立していないことから、併用は推奨できない。[「用法及び用量に関連する注意」の項参照]
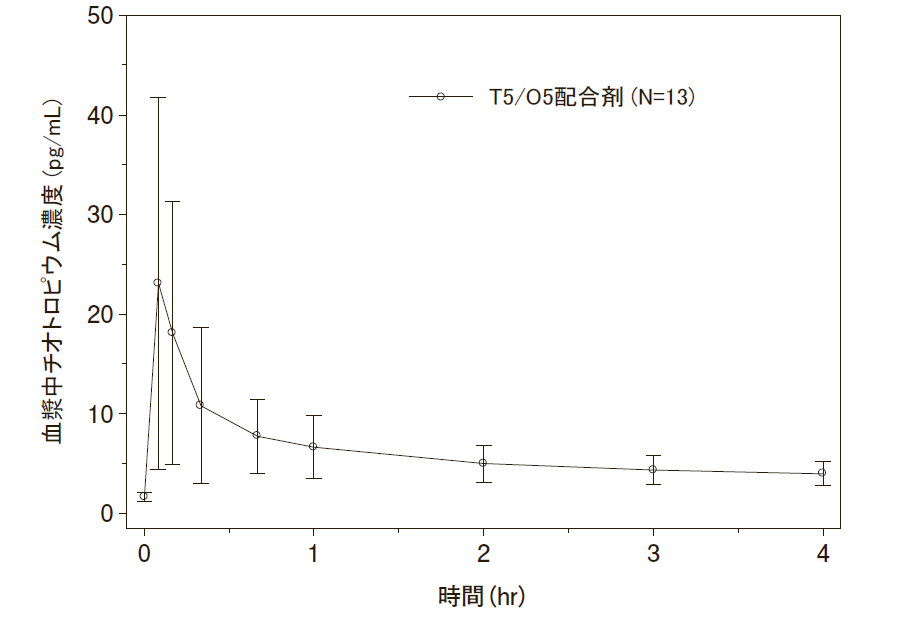
血中濃度
・チオトロピウム及びオロダテロール併用投与時
日本人COPD患者を対象に本剤を3週間反復吸入投与したときのチオトロピウム及びオロダテロールの血漿中濃度は約5分、約10分で最高値に達した¹⁾。血漿中濃度推移(算術平均±標準偏差)及び薬物動態パラメータは以下のとおりであった。
<血漿中濃度推移>
チオトロピウム
オロダテロール
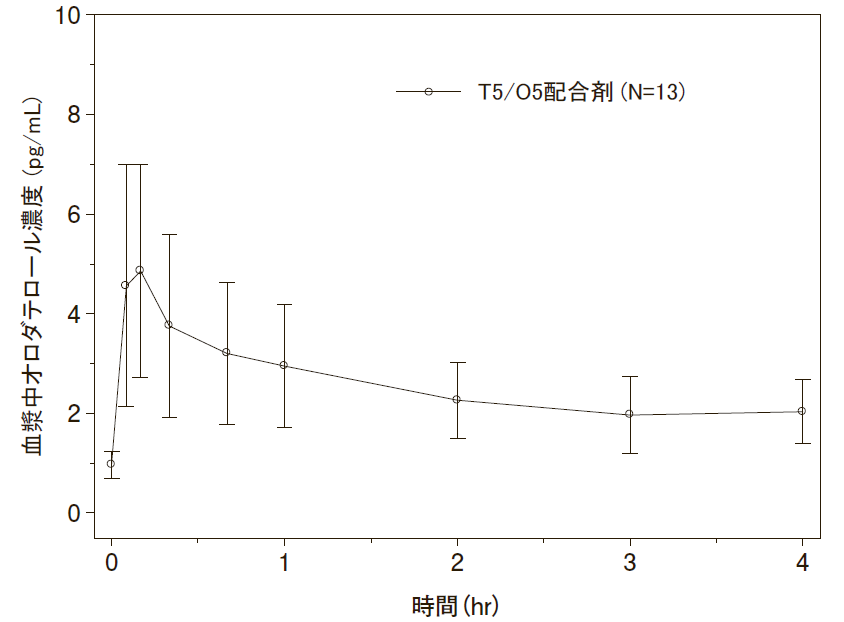
T5/O5配合剤:チオトロピウム5μg+オロダテロール5μg配合剤
<薬物動態パラメータ>
| 反復投与(21日目) | チオトロピウム | オロダテロール |
| 例数 | 13 | 13 |
| パラメータ[単位] | gMean(gCV%) | gMean(gCV%) |
| Cmax,ss[pg/mL] | 16.5(92.0) | 4.33(53.7) |
| tmax,ss[h]a) | 0.100(0.100-0.333) | 0.183(0.100-0.333) |
| AUC0-4h,ss[pg・h/mL]b) | 23.3(44.8) | 9.94(29.9) |
| fe0-4,ss[%] | 6.72(119) | 1.50(100) |
a)中央値(範囲)
b)n=12
<チオトロピウムとオロダテロールの相互作用>
COPD患者に、チオトロピウム5μg及びオロダテロール10μg注)を1日1回3週間反復吸入投与したとき、チオトロピウム及びオロダテロールとも、単独投与時と比較して顕著な薬物相互作用は認められなかった2)(外国人データ)。
注)本剤の承認された用法及び用量は、通常、成人には1回2吸入(チオトロピウムとして5μg及びオロダテロールとして5μg)を1日1回吸入投与である。
吸収
チオトロピウム(吸入液剤)を健康成人に吸入投与したとき、投与量の33%が全身循環血中に吸収されることが尿中排泄データから示された3),4)(外国人データ)。
オロダテロールを健康成人に吸入投与したときの絶対的バイオアベイラビリティは、約30%と推定された5),6)(外国人データ)。
分布
チオトロピウムの血漿蛋白との結合率(in vitro試験)は72%で7)、分布容積は32L/kgであった4)(外国人データ)。
オロダテロールの血漿蛋白との結合率(in vitro試験)は約60%で8)、分布容積は1110Lであった6)(外国人データ)。
代謝
健康成人にチオトロピウムを静脈内投与注)したとき、チオトロピウムの代謝はわずかであった4)。エステル化合物であるチオトロピウム臭化物は、非酵素的にエステル結合が加水分解され、N-メチルスコピン及びジチニールグリコール酸の生成がみられた9)。また、ヒト肝ミクロソーム及びヒト肝細胞を用いた試験でチトクロームP-450によって酸化された代謝物及びそのグルタチオン抱合体がわずかにみられ10),11)、この代謝はCYP2D6及び3A4の阻害薬により抑制された10)(外国人データ)。In vivo試験において、オロダテロールの主な代謝経路は直接的なグルクロン酸抱合化及びメトキシ部分のO-脱メチル化であった12)。オロダテロールのO-脱メチル化には、CYP2C8及びCYP2C9が関与しており13)、オロダテロールのグルクロン酸抱合体生成には、UDPグルクロン酸転移酵素UGT1A1、UGT1A7、UGT1A9及びUGT2B7が関与していた14)。
注)本剤の承認された用法及び用量は、通常、成人には1回2吸入(チオトロピウムとして5μg及びオロダテロールとして5μg)を1日1回吸入投与である。
排泄
健康成人にチオトロピウムを静脈内投与注)したとき、全身クリアランスは880mL/minで、尿中未変化体排泄率は74%であった4)。
健康成人にオロダテロールを静脈内持続投与注)したとき、全身クリアランスは872mL/minであった6)(外国人データ)。
健康成人に[14C]標識オロダテロールを静脈内投与注)したとき、投与した放射能の38%が尿中に、53%が糞中に排泄された。静脈内投与時の尿中未変化体排泄率は19%であり、6日以内に投与した放射能の90%以上が排泄された6)(外国人データ)。[「特定の背景を有する患者に関する注意の項の腎機能が高度あるいは中等度低下している患者(クレアチニンクリアランス値が50mL/min以下の患者)」、「薬物動態の腎機能低下患者」の項参照]
注)本剤の承認された用法及び用量は、通常、成人には1回2吸入(チオトロピウムとして5μg及びオロダテロールとして5μg)を1日1回吸入投与である。
特定の背景を有する患者
・腎機能低下患者
軽度の腎機能低下患者(クレアチニンクリアランスが50~80mL/minの患者)では、チオトロピウム4.8μgを静脈内投与注)後のAUC0-4hは健康成人に比較して39%高い値を示した15)。また、高度あるいは中等度の腎機能低下患者(クレアチニンクリアランスが50mL/min未満の患者)では血漿中未変化体濃度は約2倍高い値を示した(AUC0-4hは82%高かった)(外国人データ)。
高度の腎機能障害患者(クレアチニンクリアランスが30mL/min未満)では、オロダテロールを単回吸入投与注)したときのAUC0-4hは健康成人に比較して約40%増加した16)(外国人データ)。[「特定の背景を有する患者に関する注意の項の腎機能が高度あるいは中等度低下している患者(クレアチニンクリアランス値が50mL/min以下の患者)」、「薬物動態の項の排泄」の項参照]
・肝機能低下患者
オロダテロールのCmax及びAUC(投与量補正値)の肝機能障害患者/健康成人の比(90%信頼区間)は、軽度で112%(84%~151%)及び97%(75%~125%)、中等度で99%(73%~135%)及び105%(79%~140%)であった17)(外国人データ)。
・高齢者
高齢者にチオトロピウム(粉末吸入剤)を吸入投与したとき、チオトロピウムの腎クリアランスは低下した(腎クリアランスは58歳以下のCOPD 患者で326mL/min、69歳以上のCOPD患者で163mL/min)が、これは加齢に伴う腎機能の低下によるものと考えられた18)(外国人データ)。
一方、チオトロピウム(粉末吸入剤)を1日1回反復吸入投与後のAUC0-4h (幾何平均値[範囲])は、非高齢者では18.2(10.0~61.7)pg・h/mL、高齢者では26.1(10.5~56.0)pg・h/mLで、高齢者で非高齢者に比較して高かったが、個体間変動を考慮すると、血中濃度に加齢による大きな差はないと考えられた18)(外国人データ)。[「特定の背景を有する患者に関する注意の項の高齢者」の項参照]
薬物相互作用
オロダテロールとフルコナゾール19)
健康成人にオロダテロール10μg注)(吸入投与)とフルコナゾール400mg(経口投与)を1日1回14日間併用したとき、オロダテロールのCmax及びAUCの併用時/非併用時の比(90%信頼区間)は、それぞれ109%(102%~117%)及び113%(106%~121%)であった(外国人データ)。
オロダテロールとケトコナゾール20)
健康成人にオロダテロール10μg注)(吸入投与)とケトコナゾール400mg(経口投与)を1日1回14日間併用したとき、オロダテロールのCmaxが66%、AUCが68%上昇した(外国人データ)。
注)本剤の承認された用法及び用量は、通常、成人には1回2吸入(チオトロピウムとして5μg及びオロダテロールとして5μg)を1日1回吸入投与である。
その他
・心電図への影響
日本人COPD患者に本剤を3週間投与したときのベースラインからの QTcF間隔の変化量の平均値は-7.6(投与15分前)~-2.3ms(投与後1時間)であった1)。[「重要な基本的注意」、「過量投与の項の症状」、「臨床成績の項のその他」の項参照]
有効性及び安全性に関する試験
・国際共同第Ⅲ相試験(52週間投与検証試験1)
COPD患者2,624名(日本人204名を含む)を対象とした、実薬対照、ランダム化二重盲検並行群間比較試験(TONADO 1)で、本剤をCOPD患者522名(日本人45名を含む)に1日1回52週間吸入投与した。本剤は投与5分で肺機能(FEV1)の改善がみられ、投与24週後のFEV1AUC0-3h及びトラフFEV1並びにSt. George’s Respiratory Questionnaire(SGRQ)による生活の質(QOL)は単剤(チオトロピウム5μg及びオロダテロール5μg)に対して、統計学的に有意な差が示された。また、日本人集団でも同様の結果が得られた21)。
(1)投与24週後のFEV1AUC0-3h(L)
| TONADO1 | |||
| 本剤 | チオトロピウム | オロダテロール | |
| 全体集団 | |||
| ベースライン | 1.110±0.462 (522) | 1.148±0.491 (526) | 1.159±0.519 (525) |
| 投与24週後 | 1.363±0.517 (498) | 1.298±0.527 (489) | 1.314±0.575 (475) |
| 変化量 | 0.258±0.211 (498) | 0.140±0.188 (489) | 0.138±0.207 (475) |
| 本剤との群間差 [95%信頼区間]a)、p値a) | 0.117 [0.094,0.140] p<0.0001 | 0.123 [0.100,0.146] p<0.0001 | |
| 日本人部分集団 | |||
| ベースライン | 0.989±0.394(45) | 1.070±0.432(38) | 1.094±0.486(53) |
| 投与24週後 | 1.307±0.458(42) | 1.194±0.440(38) | 1.290±0.545(48) |
| 変化量 | 0.315±0.169(42) | 0.125±0.134(38) | 0.158±0.273(48) |
| 本剤との群間差 [95%信頼区間]a) | 0.184 [0.112,0.256] | 0.155 [0.087,0.222] | |
平均値±標準偏差(例数)
a)投与群、投与日、投与群と投与日の交互作用、ベースライン値、ベースライン値と投与日の交互作用を固定効果、被験者を変量効果とし、被験者内でspatial power共分散構造を仮定した反復測定混合モデル(MMRM)
(2)投与24週後のトラフFEV1(L)
| TONADO1 | |||
| 本剤 | チオトロピウム | オロダテロール | |
| 全体集団 | |||
| ベースライン | 1.110±0.462 (522) | 1.148±0.491 (526) | 1.159±0.519 (525) |
| 投与24週後 | 1.223±0.491 (498) | 1.210±0.500 (489) | 1.212±0.541 (476) |
| 変化量 | 0.118±0.183 (498) | 0.052±0.176 (489) | 0.035±0.180 (476) |
| 本剤との群間差 [95%信頼区間]a)、p値a) | 0.071 [0.047,0.094] p<0.0001 | 0.082 [0.059,0.106] p<0.0001 | |
| 日本人部分集団 | |||
| ベースライン | 0.989±0.394(45) | 1.070±0.432(38) | 1.094±0.486(53) |
| 投与24週後 | 1.199±0.438(42) | 1.125±0.434(38) | 1.214±0.524(48) |
| 変化量 | 0.207±0.147(42) | 0.055±0.143(38) | 0.083±0.240(48) |
| 本剤との群間差 [95%信頼区間]a) | 0.152 [0.085,0.218] | 0.134 [0.072,0.196] | |
平均値±標準偏差(例数)
a)投与群、投与日、投与群と投与日の交互作用、ベースライン値、ベースライン値と投与日の交互作用を固定効果、被験者を変量効果とし、被験者内でspatial power共分散構造を仮定した反復測定混合モデル(MMRM)
(3)安全性
副作用は本剤投与症例522例中36例(6.9%)で報告され、主な副作用は口渇11例(2.1%)であった。
・国際共同第Ⅲ相試験(52週間投与検証試験2)
COPD患者2538名(日本人209名を含む)を対象とした、実薬対照、ランダム化二重盲検並行群間比較試験(TONADO 2)で、本剤をCOPD患者507名(日本人34名を含む)に1日1回52週間吸入投与した。本剤は投与5分で肺機能(FEV1)の改善がみられ、投与24週後のFEV1AUC0-3h及びトラフFEV1並びにSt. George’s Respiratory Questionnaire(SGRQ)による生活の質(QOL)は単剤(チオトロピウム5μg及びオロダテロール5μg)に対して、統計学的に有意な差が示された。また、日本人集団でも同様の結果が得られた22)。
(1)投与24週後のFEV1AUC0-3h(L)
| TONADO2 | |||
| 本剤 | チオトロピウム | オロダテロール | |
| 全体集団 | |||
| ベースライン | 1.154±0.516 (502) | 1.146±0.499 (500) | 1.173±0.490 (507) |
| 投与24週後 | 1.413±0.569 (455) | 1.307±0.555 (460) | 1.325±0.527 (452) |
| 変化量 | 0.271±0.240 (455) | 0.166±0.222 (460) | 0.139±0.210 (452) |
| 本剤との群間差 [95%信頼区間]a)、p値a) | 0.103 [0.078,0.127] p<0.0001 | 0.132 [0.108,0.157] p<0.0001 | |
| 日本人部分集団 | |||
| ベースライン | 1.185±0.588(34) | 1.146±0.507(37) | 1.207±0.418(54) |
| 投与24週後 | 1.414±0.530(30) | 1.361±0.550(36) | 1.369±0.394(49) |
| 変化量 | 0.279±0.203(30) | 0.201±0.145(36) | 0.138±0.209(49) |
| 本剤との群間差 [95%信頼区間]a) | 0.078 [0.006,0.150] | 0.143 [0.076,0.211] | |
平均値±標準偏差(例数)
a)投与群、投与日、投与群と投与日の交互作用、ベースライン値、ベースライン値と投与日の交互作用を固定効果、被験者を変量効果とし、被験者内でspatial power共分散構造を仮定した反復測定混合モデル(MMRM)
(2)投与24週後のトラフFEV1(L)
| TONADO2 | |||
| 本剤 | チオトロピウム | オロダテロール | |
| 全体集団 | |||
| ベースライン | 1.154±0.516 (502) | 1.146±0.499 (500) | 1.173±0.490 (507) |
| 投与24週後 | 1.265±0.530 (455) | 1.213±0.526 (460) | 1.219±0.505 (452) |
| 変化量 | 0.123±0.213 (455) | 0.073±0.199 (460) | 0.033±0.196 (452) |
| 本剤との群間差 [95%信頼区間]a)、p値a) | 0.050 [0.024,0.075] p=0.0001 | 0.088 [0.063,0.113] p<0.0001 | |
| 日本人部分集団 | |||
| ベースライン | 1.185±0.588(34) | 1.146±0.507(37) | 1.207±0.418(54) |
| 投与24週後 | 1.311±0.507(30) | 1.290±0.555(36) | 1.286±0.390(49) |
| 変化量 | 0.176±0.161(30) | 0.129±0.145(36) | 0.055±0.203(49) |
| 本剤との群間差 [95%信頼区間]a) | 0.059 [-0.014,0.131] | 0.124 [0.056,0.192] | |
平均値±標準偏差(例数)
a)投与群、投与日、投与群と投与日の交互作用、ベースライン値、ベースライン値と投与日の交互作用を固定効果、被験者を変量効果とし、被験者内でspatial power共分散構造を仮定した反復測定混合モデル(MMRM)
(3)生活の質(QOL)に関する成績
同じ試験デザインで実施した国際共同第Ⅲ相試験(52週間投与検証試験)2試験の併合データにおいて、投与24週でのSGRQ総スコアは、本剤はベースラインから6.8改善(減少)し、本剤とオロダテロール5μgの差は-1.693(p=0.0022)、本剤とチオトロピウム5μgの差は-1.233(p=0.0252)で、本剤は各単剤と比較して統計学的に有意に優れていた。本剤のレスポンダー割合注)は57.5%で、オロダテロール5μg(44.8%、 オッズ比1.6703、[p<0.0001])及びチオトロピウム5μg(48.7%、オッ ズ比1.4261[p=0.0001])と比較して統計学的に有意に優れていた23)。
注)投与24週のSGRQ総スコアがベースラインと比較して臨床的に意味のある最小の差である4以上の改善があった患者の割合
(4)安全性
副作用は本剤投与症例507例中37例(7.3%)で報告され、主な副作用は咳嗽6例(1.2%)であった。
・国内第Ⅲ相試験
COPD患者122名を対象とした、実薬対照、ランダム化二重盲検並行群間比較試験で、本剤をCOPD患者41名に1日1回52週間吸入投与した。本剤投与例41例中3例(7.3%)で副作用が報告され、振戦、便秘、日光皮膚炎が各1例(2.4%)報告された。本試験及び国際共同第Ⅲ相試験に参加した日本人患者(本剤投与120名)で、投与52週時のベースラインからの変化量は、FEV1AUC0-3hで0.247L、トラフFEV1で0.148Lであり、日本人患者集団における52週までの効果の継続が確認された21),22),24)。
その他
健康成人にオロダテロールを単回吸入投与したときの、QTcI間隔(個体ごとに補正したQT間隔)のベースラインからの変化量のプラセボと の差の最大値(調整済み平均値[両側90%信頼区間])は、オロダテロール10、20、30及び50μg投与でそれぞれ2.1ms[-1.4、5.5]、6.3ms[2.3、10.2]、7.7ms[3.7、11.8]、8.6ms[4.7、12.6]であった25)(外国人データ)。[「重要な基本的注意」、「過量投与の項の症状」、「薬物動態の項の心電図への影響」の項参照]
作用機序
・チオトロピウム
チオトロピウムは長時間持続型の選択的ムスカリン受容体拮抗薬であり、ムスカリン受容体のサブタイプであるM1~M5受容体にほぼ同程度の親和性を示す26)。気道においては、気道平滑筋のM3受容体に対するアセチルコリンの結合を阻害して気管支収縮抑制作用を発現する。
・オロダテロール
オロダテロールは長時間持続型ヒトβ2受容体刺激薬であり、in vitro試験において、オロダテロールはhβ1-AR及びhβ3-ARと比較するとhβ2-ARに対して241倍及び2299倍の刺激作用を示した。吸入による局所投与後、オロダテロールはhβ2-ARを活性化することで細胞内のアデニル酸シクラーゼを活性化し、環状アデノシン一リン酸(cAMP)の生成を促し、気管支平滑筋を弛緩させる。
気管支収縮抑制作用及び作用持続時間
・チオトロピウム
非臨床試験(摘出標本及びウサギ、イヌの生体位)において示された気管支収縮抑制作用は用量依存的であり、この作用は24時間以上持続する27),28)。摘出標本を用いた検討により、気管支収縮に対する抑制作用(M3受容体拮抗作用)はアセチルコリン遊離増強作用(M2受容体拮抗作用)に比べ持続することが明らかとなっている。
・オロダテロール
モルモット及びイヌのアセチルコリン誘発性気管支収縮モデルにおいて、オロダテロールは用量に依存した気管支収縮抑制作用を示し、その作用は24時間持続した29)。
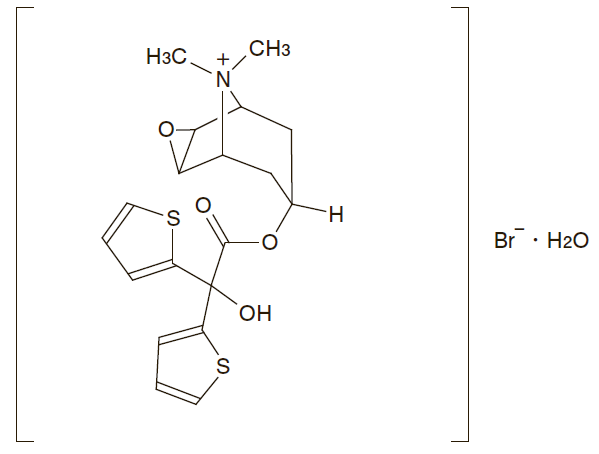
一般的名称 : チオトロピウム臭化物水和物(Tiotropium Bromide Hydrate)
化学名 : (1α,2β,4β,5α,7β)-7-[(Hydroxydi-2-thienylacetyl)oxy]-9,9-dimethyl-3-oxa-9-azoniatricyclo[3.3.1.02,4]nonane bromide monohydrate
分子式 : C19H22BrNO4S2・H2O
分子量 : 490.43
性状 : 白色~帯黄白色の粉末又は結晶である。
化学構造式 :
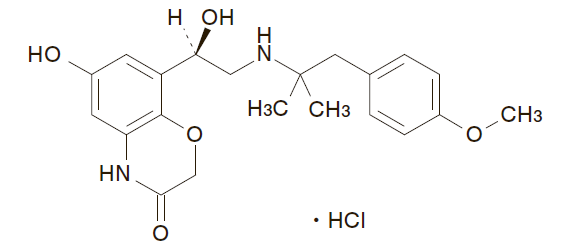
一般的名称 : オロダテロール塩酸塩(Olodaterol Hydrochloride)
化学名 : 6-Hydroxy-8-((1R)-1-hydroxy-2-{[2-(4-methoxyphenyl)-1,1-dimethylethyl]amino}ethyl)-2H-1,4-benzoxazin-3(4H)-one monohydrochloride
分子式 : C21H26N2O5・HCl
分子量 : 422.90
性状 : 白色の粉末である。メタノール及びN,N-ジメチルホルムアミドに溶けやすく、水にやや溶けやすく、エタノール(99.5)にやや溶けにくく、 アセトニトリルにほとんど溶けない。
化学構造式 :
本剤は冷凍しないこと。
地方自治体により定められた廃棄処理方法に従うこと。
<スピオルト®レスピマット®28吸入>
吸入用器具レスピマット®1個及びカートリッジ1本(0.5mL:28噴霧[14回投与分])
<スピオルト®レスピマット®60吸入>
吸入用器具レスピマット®1個及びカートリッジ1本(1mL:60噴霧[30回投与分])
- 社内資料:日本人COPD患者を対象とした3週間投与薬物動態試験(2015年9月28日承認、CTD 2.7.6 1.9)
- 社内資料:COPD患者を対象とした3週間投与DDI試験(2015年9月28日承認、CTD 2.7.6 1.10)
- 社内資料:健康成人での反復投与薬物動態試験(2015年9月28日承認、 CTD 2.7.2B 1.1)
- 社内資料:健康成人でのバイオアベイラビリティ試験(2015年9月28日承認、CTD 2.7.2B 1.1)
- 社内資料:健康被験者を対象とした用量漸増単回吸入投与試験(2015年9月28日承認、CTD 2.7.6 1.1)
- 社内資料:健康被験者を対象とした静脈内及び経口投与によるヒト ADME試験(2015年9月28日承認、CTD 2.7.6 1.4)
- 社内資料:チオトロピウムの薬物動態試験(分布:血漿蛋白結合)(2004年10月22日承認臭化チオトロピウム水和物 スピリーバ吸入用カプセ ル18μg、申請資料概要ヘ 2.2.5)
- 社内資料:オロダテロールの薬物動態試験(分布:血漿蛋白結合)(2015年9月28日承認、CTD 2.6.4 4.2.3)
- 社内資料:チオトロピウムの薬物動態試験(代謝:血漿中加水分解)(2004年10月22日承認臭化チオトロピウム水和物 スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
- 社内資料:チオトロピウムの薬物動態試験(代謝:肝ミクロソーム)(2004年10月22日承認臭化チオトロピウム水和物 スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
- 社内資料:チオトロピウムの薬物動態試験(代謝:肝細胞)(2004年10 月22日承認臭化チオトロピウム水和物 スピリーバ吸入用カプセル18 μg、申請資料概要ヘ 2.3.2)
- 社内資料:オロダテロールの薬物動態試験(代謝:ヒトにおける代謝)(2015年9月28日承認、CTD 2.7.2A 3.2.2)
- 社内資料:オロダテロールの薬物動態試験(代謝:チトクロームP450及び肝細胞)(2015年9月28日承認、CTD 2.6.4 5.2.1)
- 社内資料:オロダテロールの薬物動態試験(代謝:in vitro phase Ⅱ 酵素)(2015年9月28日承認、CTD 2.6.4 5.2.1)
- Tuerck D,et al.:J Clin Pharmacol.2004;44(2):163-172
- 社内資料:腎機能障害患者を対象とした試験(2015年9月28日承認、CTD 2.7.6 1.12)
- 社内資料:肝機能障害患者を対象とした試験(2015年9月28日承認、CTD 2.7.6 1.11)
- 社内資料:高齢者における薬物動態試験(2004年10月22日承認臭化チオトロピウム水和物 スピリーバ吸入用カプセル18μg、申請資料概要ヘ 3.5)
- 社内資料:フルコナゾールとの薬物相互作用試験(2015年9月28日承認、CTD 2.7.6 1.14)
- 社内資料:ケトコナゾールとの薬物相互作用試験(2015年9月28日承認、CTD 2.7.6 1.13)
- 社内資料:COPD患者を対象とした52週間投与第Ⅲ相国際共同試験 (TONADO 1)(2015年9月28日承認、CTD 2.7.6 3.11)
- 社内資料:COPD患者を対象とした52週間投与第Ⅲ相国際共同試験 (TONADO 2)(2015年9月28日承認、CTD 2.7.6 3.12)
- 社内資料:COPD患者を対象とした52週間投与第Ⅲ相国際共同試験の併合解析(2015年9月28日承認、CTD 2.7.6 3.17)
- 社内資料:日本人COPD患者を対象とした52週間投与第Ⅲ相試験(2015年9月28日承認、CTD 2.7.6 3.13)
- 社内資料:オロダテロールのTQT試験(2015年9月28日承認、CTD 2.7.6 2.1)
- 社内資料:薬効薬理試験(ヒトムスカリン受容体への親和性)(2004 年10月22日承認臭化チオトロピウム水和物スピリーバ吸入用カプセ ル18μg、申請資料概要ホ 1.5.7)
- 社内資料:薬効薬理試験(抗コリン作用(ウサギ、イヌ)など)(2004年 10月22日承認臭化チオトロピウム水和物スピリーバ吸入用カプセル 18μg、申請資料概要ホ 1.1.3)
- 大村剛史ほか:医学と薬学.2004;51(5):711-716
- Bouyssou T,et al.:J Pharmacol Exp Ther.2010;334(1):53-62


