
心腎連関に対するSGLT2阻害薬の作用機序とジャディアンスの10年のエビデンスを紐解く
サイトへ公開:2025年02月27日 (木)
クイックリンク
山口大学 佐野元昭先生に、心腎連関に対するSGLT2阻害薬の作用機序を中心に、SGLT2阻害薬の一つであるジャディアンスの10年のエビデンスをご解説いただきました。


腎機能低下は、心不全における予後悪化リスクのひとつです
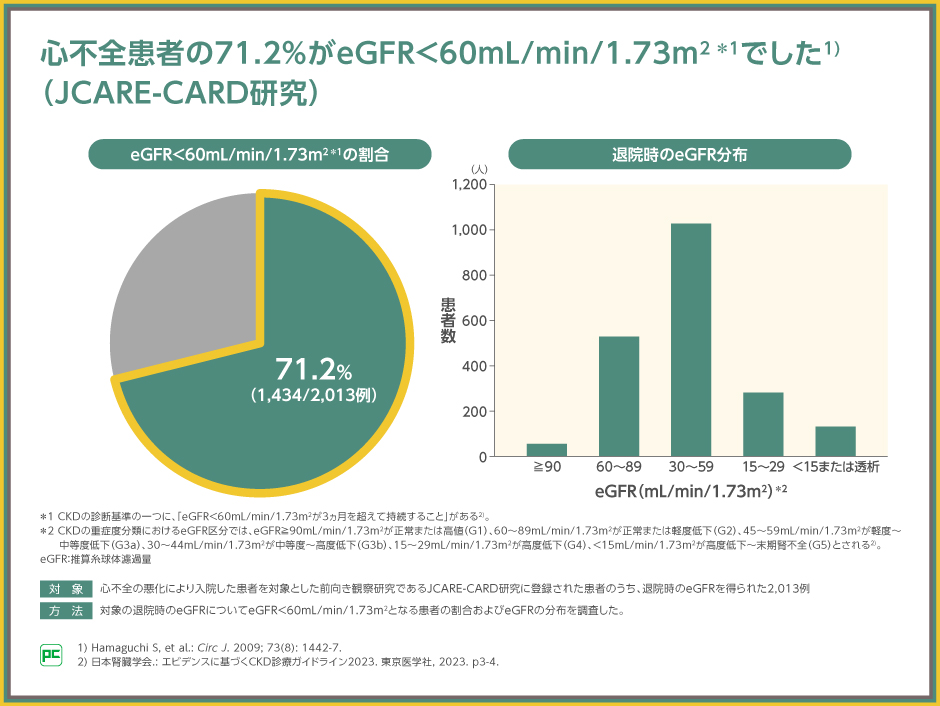
心不全患者では腎機能が低下していることが多く、腎機能低下は慢性心不全の重要な予後規定因子であるといわれています1,2)。
JCARE-CARD研究では、心不全患者の71.2%がeGFR<60mL/min/1.73m2であると報告されました。eGFR<60mL/min/1.73m2はCKDステージG3a以降に該当することから3)、心不全患者の7割で腎機能が低下した状態であったことを示します。
1) 日本循環器学会, 日本心不全学会.:急性・慢性心不全診療ガイドライン(2017年改訂版), p66, 2022年4月1日更新
https://www.j-circ.or.jp/cms/wp-content/uploads/2017/06/JCS2017_tsutsui_h.pdf
(2024年11月29日閲覧)
2) Damman K, et al.: Eur Heart J. 2014; 35(7): 455-69.
3) 日本腎臓学会.: エビデンスに基づくCKD診療ガイドライン2023. 東京医学社, 2023. p4
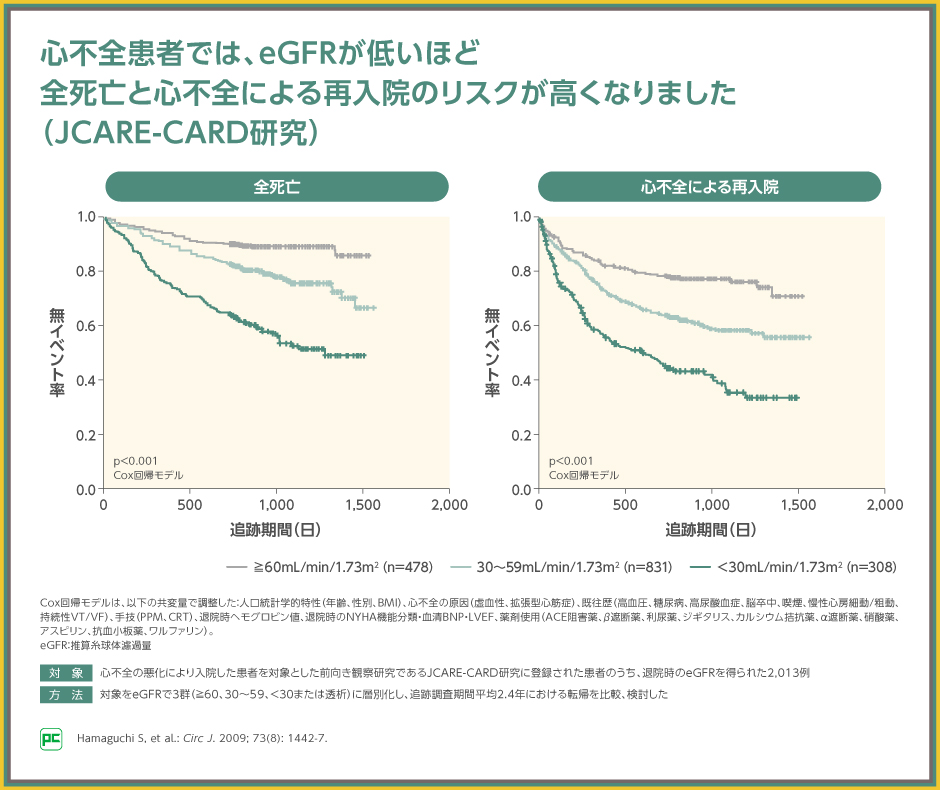
同研究では、eGFR≧60mL/min/1.73m2の群、eGFR 30~59mL/min/1.73m2の群、eGFR<30mL/min/1.73m2の群の順に全死亡のリスクおよび心不全による再入院のリスクの両方が高くなり(ともにp<0.001、Cox回帰モデル)、eGFRが低下するほど予後が悪化したと報告されました。
心腎連関とSGLT2阻害薬
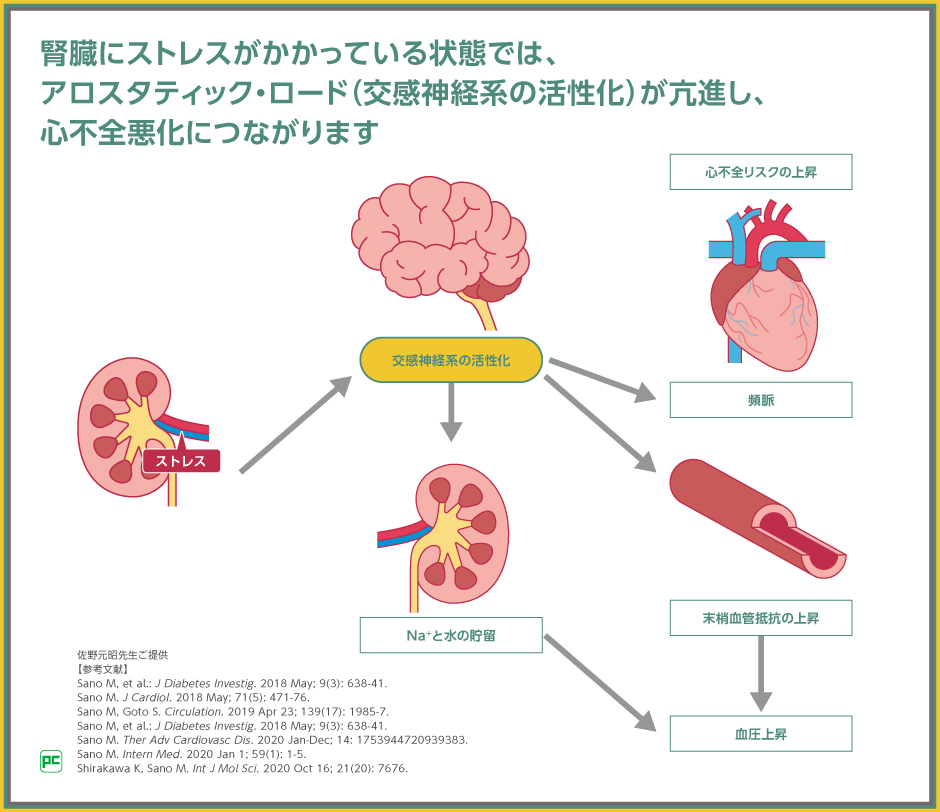
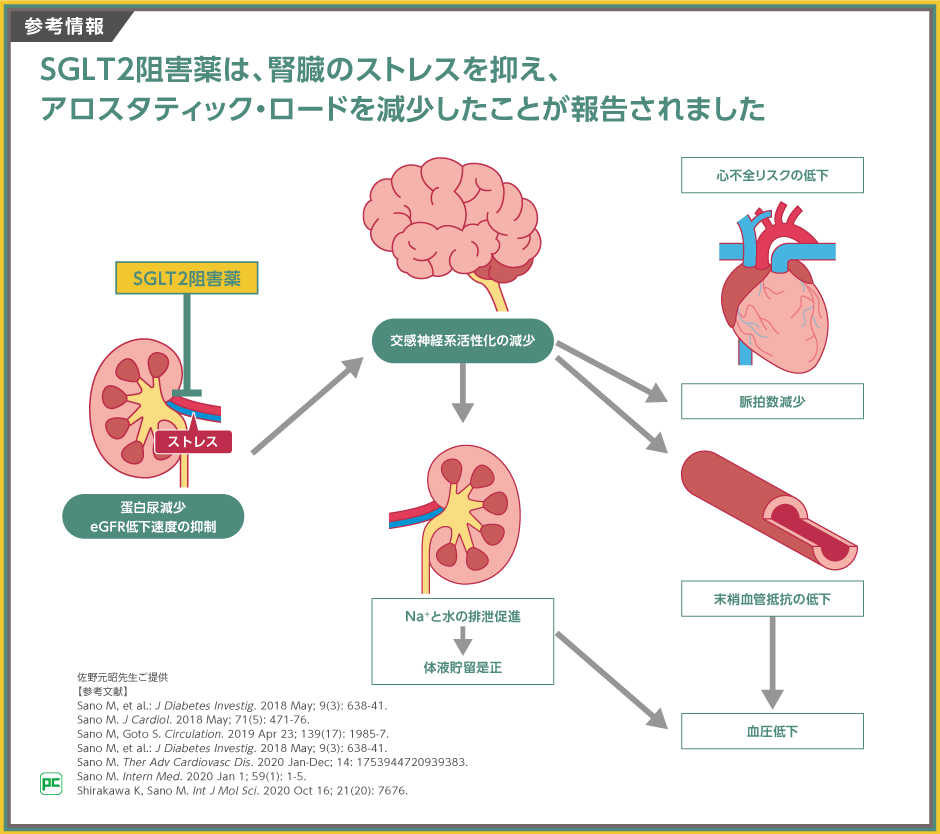
腎機能が心不全の予後に影響する理由として、心腎連関が挙げられますが、その成因の一つはアロスタティック・ロード(交感神経系の活性化)であると考えられています。
心不全患者では、血行動態の悪化により、腎臓にかかるストレスが増大します。腎臓にストレスがかかっているという情報は、求心性神経を介して脳へと伝達され、アロスタティック・ロードを引き起こします。アロスタティク・ロードが長期化すると、血管収縮や、ナトリウムと水分の貯留、頻脈、血圧上昇等を呈して、心不全の悪化につながります。
このメカニズムから、心不全治療では、SGLT2阻害薬を使用して、腎臓にかかっているストレスを軽減することが重要であると考えます。
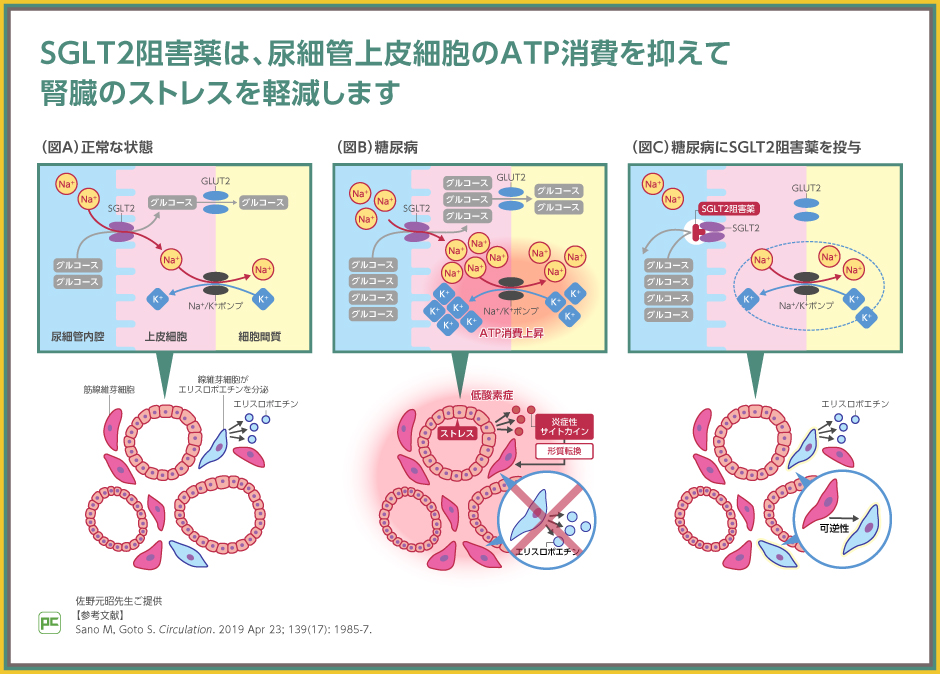
ここで、腎臓にストレスがかかっている状態でのSGLT2の働きとSGLT2阻害薬の働きを振り返ります。
正常な状態(図A)では、尿細管上皮細胞周囲の線維芽細胞がエリスロポエチンを産生します。
糖尿病や心不全等で腎臓にストレスがかかっている状態(図B)では、SGLT2によりナトリウムおよびグルコースの過剰な取り込みが行われ、SGLT2に隣接するナトリウム-カリウムポンプによるATP消費が亢進します。ATP消費の亢進に伴い、酸素消費も亢進するため、尿細管上皮細胞周囲に局所的な低酸素状態が生じ、炎症性サイトカインが放出されます。炎症性サイトカインは線維芽細胞の筋線維芽細胞への転換を促進するため、低酸素状態にもかかわらず、エリスロポエチンの産生が減少し、低酸素状態の長期化や悪化等、腎臓にストレスがかかった状態となります。
このようなグルコース代謝の異常が生じている状態に対してSGLT2阻害薬を投与すると(図C)、ナトリウムおよびグルコースの過剰な取り込みが阻害されるため、尿細管上皮細胞でのナトリウム-カリウムポンプによるATP消費の抑制と局所的な低酸素状態の解消、炎症性サイトカイン放出の抑制につながります。炎症性サイトカインに曝露されない状態では、筋線維芽細胞は線維芽細胞に戻ることから、エリスロポエチンの産生が再開され、酸素供給につながり、腎臓にかかるストレスが軽減します。
図では糖尿病のある方の例を示していますが、糖尿病を併発していない慢性心不全患者においても、腎臓の過負荷状態では尿細管上皮細胞のグルコース代謝の異常が生じていると考えます。
【参考情報】
SGLT2阻害薬は、前述のように腎臓のストレスを抑えるため、中枢神経を介したアロスタティック・ロードを減少したことが報告されました 。 この働きが、脈拍数減少や末梢血管抵抗の低下 、体液貯留是正、血圧低下を介して、心不全リスクの低下につながると考えています。
10年間エビデンスを構築してきたジャディアンス
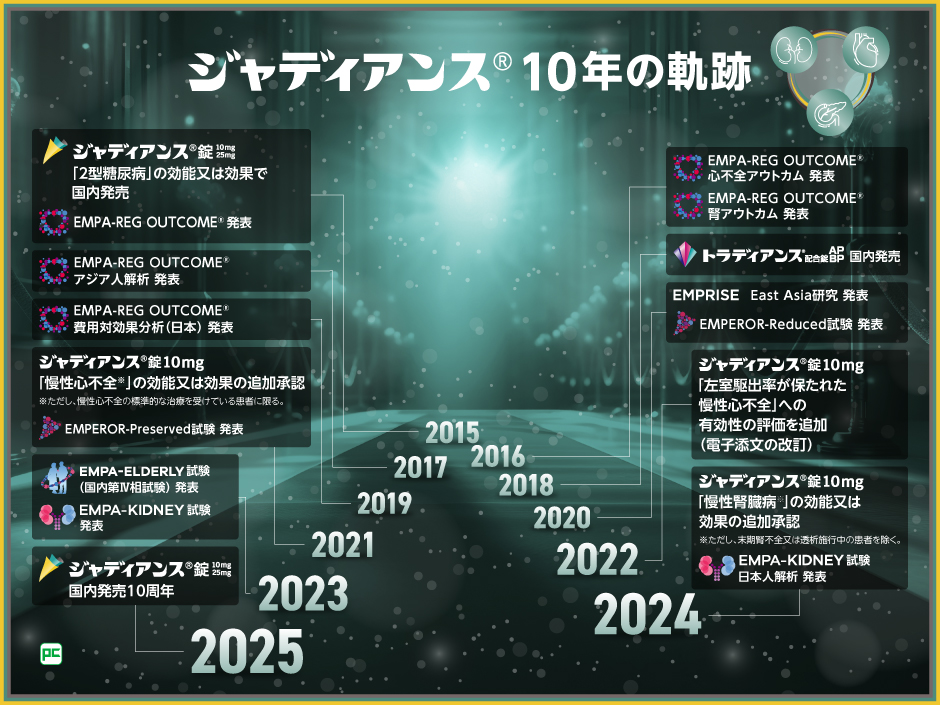
SGLT2阻害薬であるジャディアンスは、2015年に2型糖尿病の治療薬として国内で発売されて以来、EMPA-REG OUTCOME®をはじめとして、様々な臨床試験を行ってきました。
その結果、2021年には慢性心不全※1、2024年には慢性腎臓病※2への適応が追加承認されました。
※1 ただし、慢性心不全の標準的な治療を受けている患者に限る。
※2 ただし、末期腎不全又は透析施行中の患者を除く。
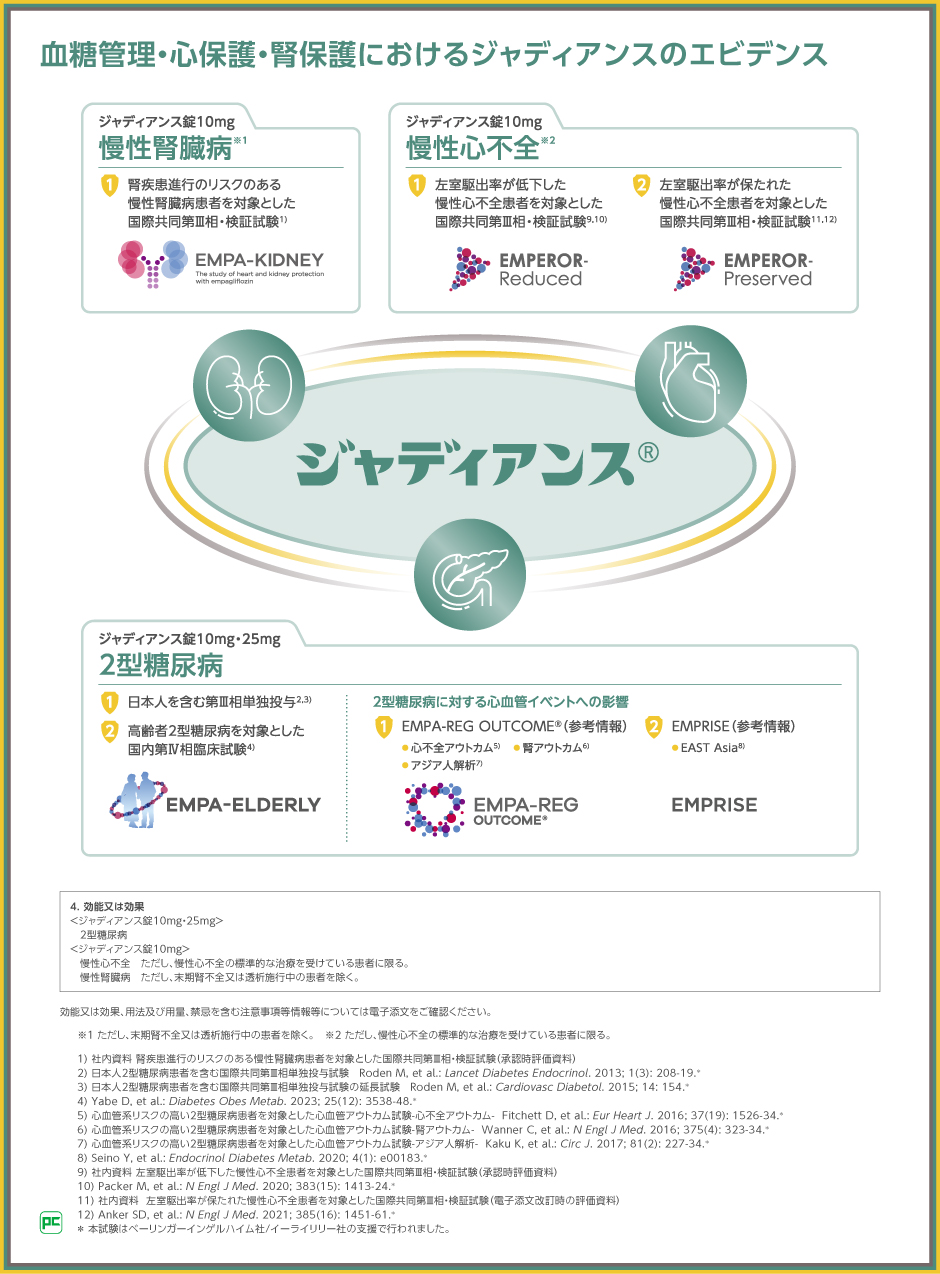
血糖管理だけでなく、心保護、腎保護についても、ジャディアンスの有効性と安全性を検討する複数の臨床試験を行い、エビデンスを構築してきました。
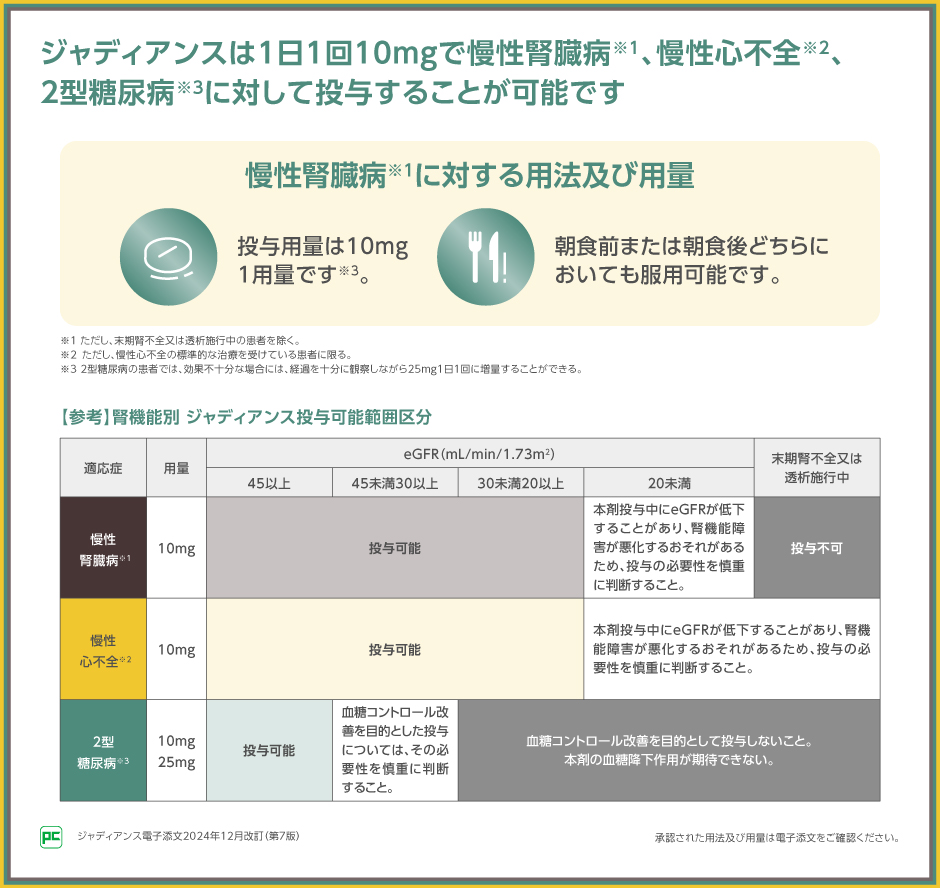
ジャディアンスは、慢性腎臓病※1、慢性心不全※2に対しては、1日1回10mg、2型糖尿病に対しては1日1回10mgまたは25mgの用量が設定されており、2型糖尿病に対しては治療強化が可能です。
※1 ただし、末期腎不全又は透析施行中の患者を除く。
※2 ただし、慢性心不全の標準的な治療を受けている患者に限る。
ジャディアンスのエビデンス①
EMPEROR-Reduced試験/EMPEROR-Preserved試験
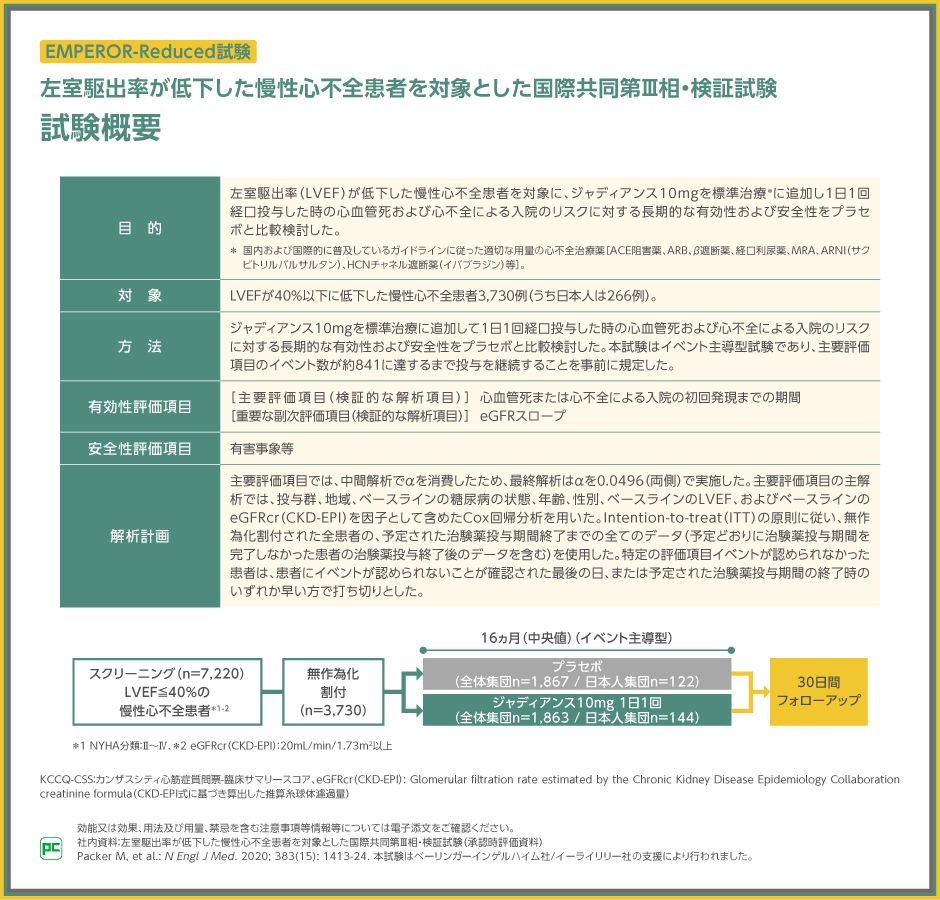
ここから、慢性心不全に対する有効性を検討したEMPEROR-Reduced試験とEMPEROR-Preserved試験を紹介します。
左室駆出率40%以下の慢性心不全患者(HFrEF)を対象としたEMPEROR-Reduced試験では、ジャディアンス10mgを1日1回経口投与した時の有効性および安全性のプラセボ群と比較検討を、全体集団解析に加え、CKD合併とCKD非合併に分けた事前規定されたサブグループ解析で行いました。
なお、CKD合併の定義は、eGFR<60mL/min/1.73m2または尿中アルブミン/クレアチニン比(UACR)>300mg/gとしました。

左室駆出率40%超の慢性心不全患者(HFpEF)を対象としたEMPEROR-Preserved試験でも、ジャディアンス10mgを1日1回経口投与した時の有効性および安全性のプラセボ群と比較検討を、全体集団解析に加え、CKD合併とCKD非合併に分けた事前規定されたサブグループ解析で行いました。
なお、CKD合併の定義はeGFR<60mL/min/1.73m2またはUACR>300mg/gとしました。
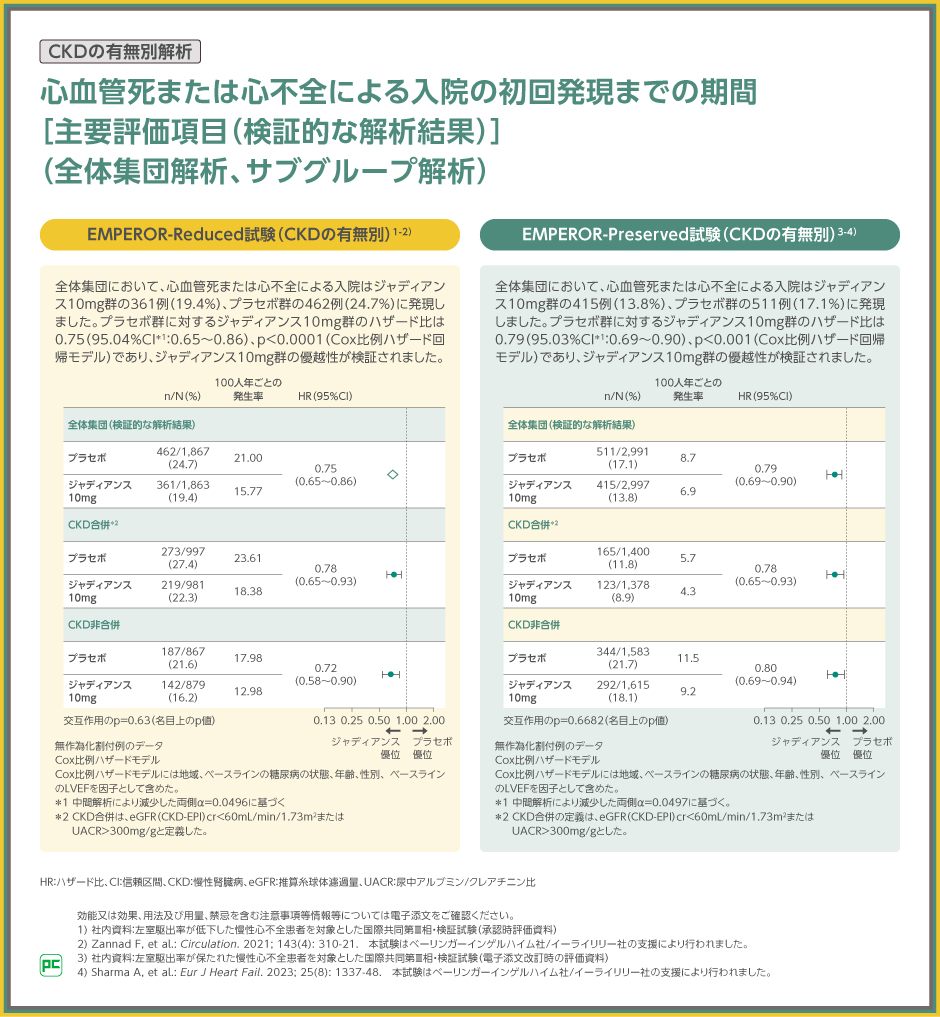
EMPEROR-Reduced試験の全体集団における、心血管死または心不全による入院のプラセボ群に対するジャディアンス10mg群のハザード比は0.75(95.04%CI:0.65~0.86)、p<0.0001(Cox比例ハザード回帰モデル)であり、ジャディアンス10mg群の優越性が検証されました。
また、CKD合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.78(95%CI:0.65~0.93)、CKD非合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.72(95%CI:0.58~0.90)(交互作用のp値:0.63、名目上のp値)でした。
EMPEROR-Preserved試験の全体集団における、心血管死または心不全による入院のプラセボ群に対するジャディアンス10mg群のハザード比は0.79(95.03%CI:0.69~0.90)、p<0.001(Cox比例ハザード回帰モデル)であり、ジャディアンス10mg群の優越性が検証されました。
また、CKD合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.78(95%CI:0.65~0.93)、CKD非合併でのプラセボ群に対するジャディアンス10mg群のハザード比は0.80(95%CI:0.69~0.94)(交互作用のp値:0.6682、名目上のp値)でした。
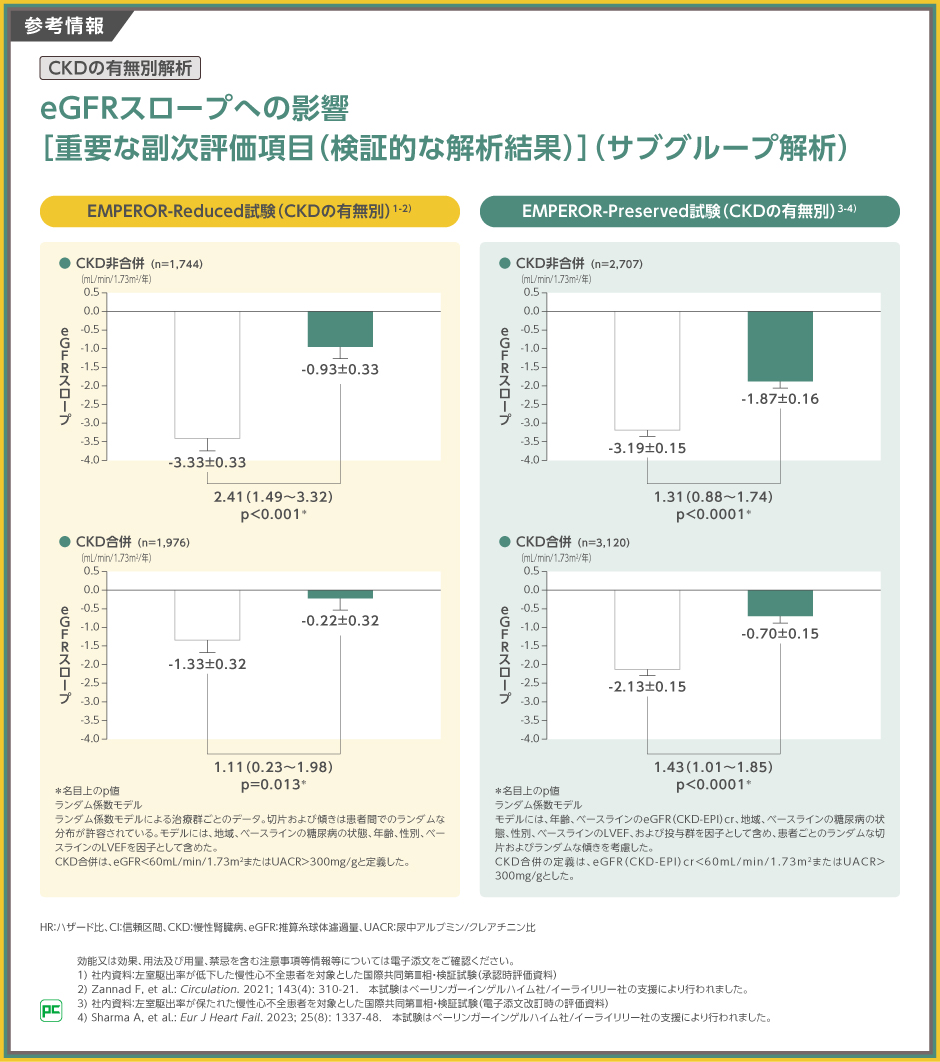
【参考情報】
腎機能への影響について、eGFRスロープ(mL/min/1.73m2/年)(負の値が小さいほど、1年あたりのeGFRの低下が少ないことを示す)を検討しました。
EMPEROR-Reduced試験では、CKD合併のジャディアンス10mg群で-0.22±0.32、プラセボ群で-1.33±0.32、CKD非合併のジャディアンス10mg群で-0.93±0.33、プラセボ群で-3.33±0.33でした。ジャディアンス10mg群とプラセボ群の差はCKD合併で1.11、CKD非合併で2.41でした。
EMPEROR-Preserved試験では、CKD合併のジャディアンス10mg群で-0.70±0.15、プラセボ群で-2.13±0.15、CKD非合併のジャディアンス10mg群で-1.87±0.16、プラセボ群で-3.19±0.15でした。ジャディアンス10mg群とプラセボ群の差はCKD合併で1.43、CKD非合併で1.31でした。

EMPEROR-Reduced試験における有害事象の発現割合はジャディアンス10mg群で76.2%でした。
主な有害事象は、ジャディアンス10mg群で心不全17.8%、低血圧7.0%、腎機能障害5.6%等でした。
また、重篤な有害事象は、ジャディアンス10mg群で心不全332例、心室性頻脈55例、肺炎53例等でした。
なお、投与中止、死亡に至った有害事象は表のとおりでした。
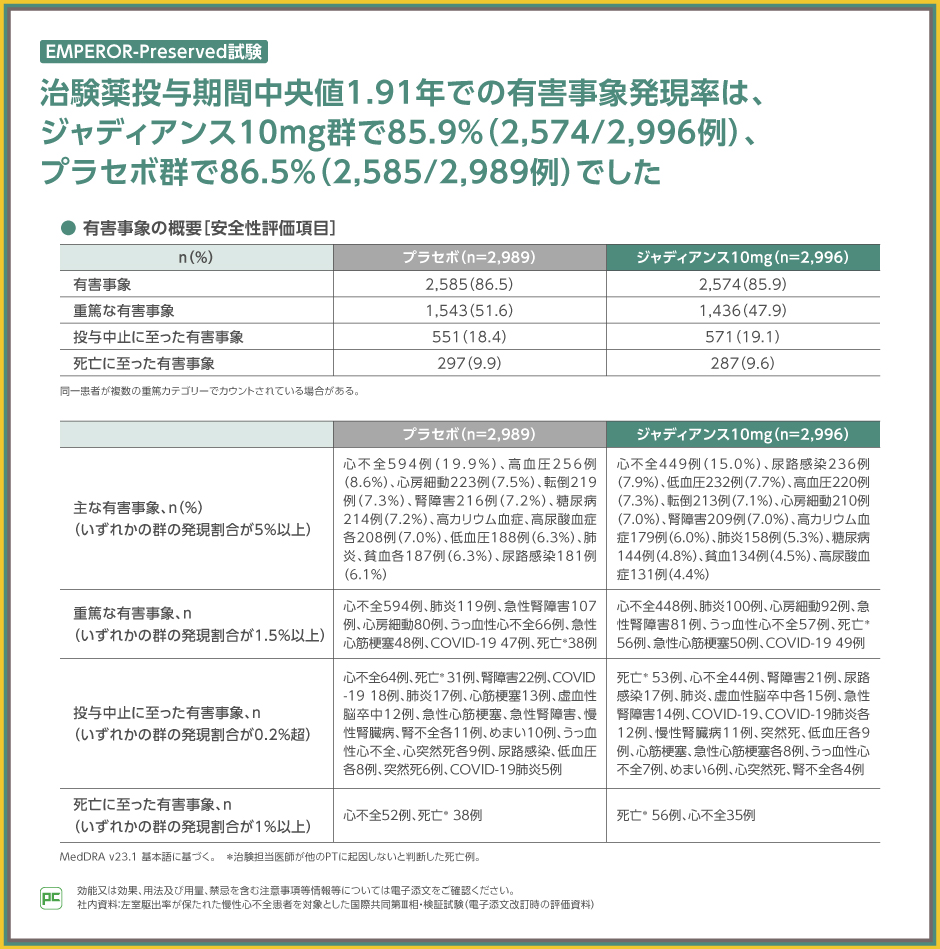
EMPEROR-Preserved試験における有害事象の発現割合はジャディアンス10mg群で85.9%でした。
主な有害事象は、ジャディアンス10mg群で心不全15.0%、尿路感染7.9%、低血圧7.7%等でした。
また、重篤な有害事象は、ジャディアンス10mg群で心不全448例、肺炎100例、心房細動92例等でした。
なお、投与中止、死亡に至った有害事象は表のとおりでした。
ジャディアンスのエビデンス②
EMPA-KIDNEY試験

こちらは、慢性腎臓病患者を対象にしたEMPA-KIDNEY試験です。
EMPA-KIDNEY試験は、糖尿病合併の有無にかかわらず、腎疾患進行のリスクのある慢性腎臓病患者を対象とし、ジャディアンス10mgを1日1回経口投与した時の有効性および安全性をプラセボと比較検討しました。

腎疾患進行または心血管死のプラセボ群に対するジャディアンス10mg群のハザード比は0.73(99.83%CI:0.59~0.89)、p<0.0001(Cox回帰モデル)であり、ジャディアンス10mg群の優越性が検証されました。
また、事前規定された日本人集団解析では、主要評価項目について、56%のリスク低下が認められました(p=0.0004、名目上のp値、Cox回帰モデル)。
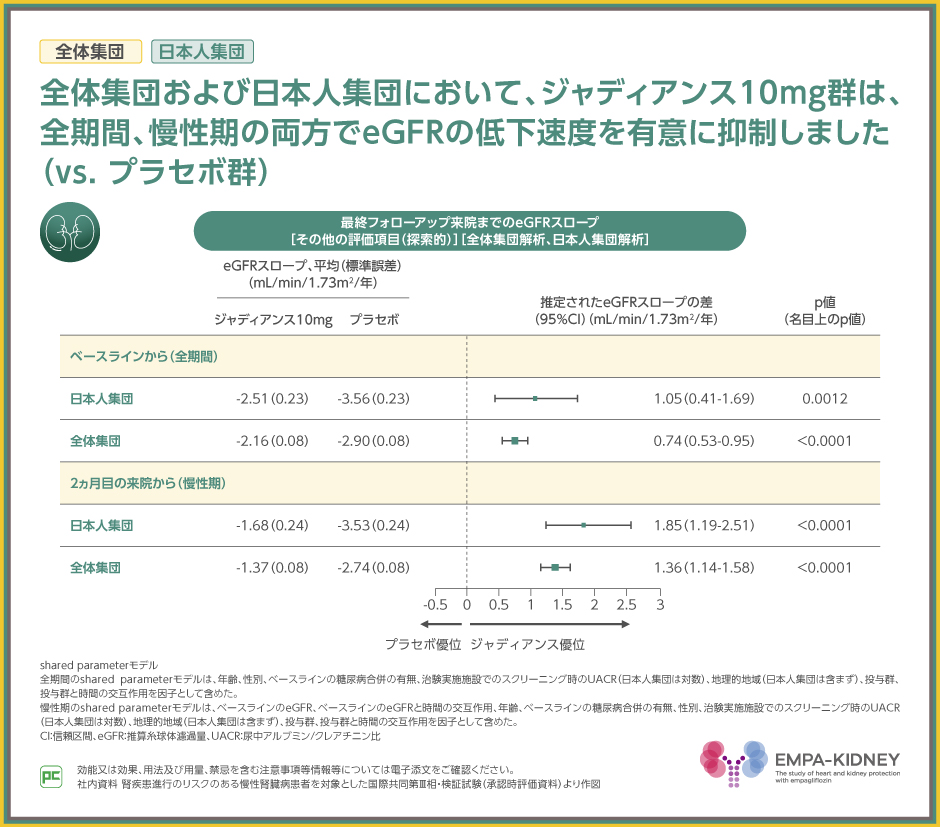
EMPA-KIDNEY試験でもeGFRの低下速度に対する作用としてeGFRスロープを検討しました。
その結果、全体集団および日本人集団において、全期間、慢性期の両方で、ジャディアンス10mg群は、eGFRの低下速度を有意に抑制しました(vs. プラセボ群、全体集団の全期間・慢性期および日本人集団の慢性期:p<0.0001、日本人集団の全期間:p=0.0012、いずれも名目上のp値、shared parameterモデル)。
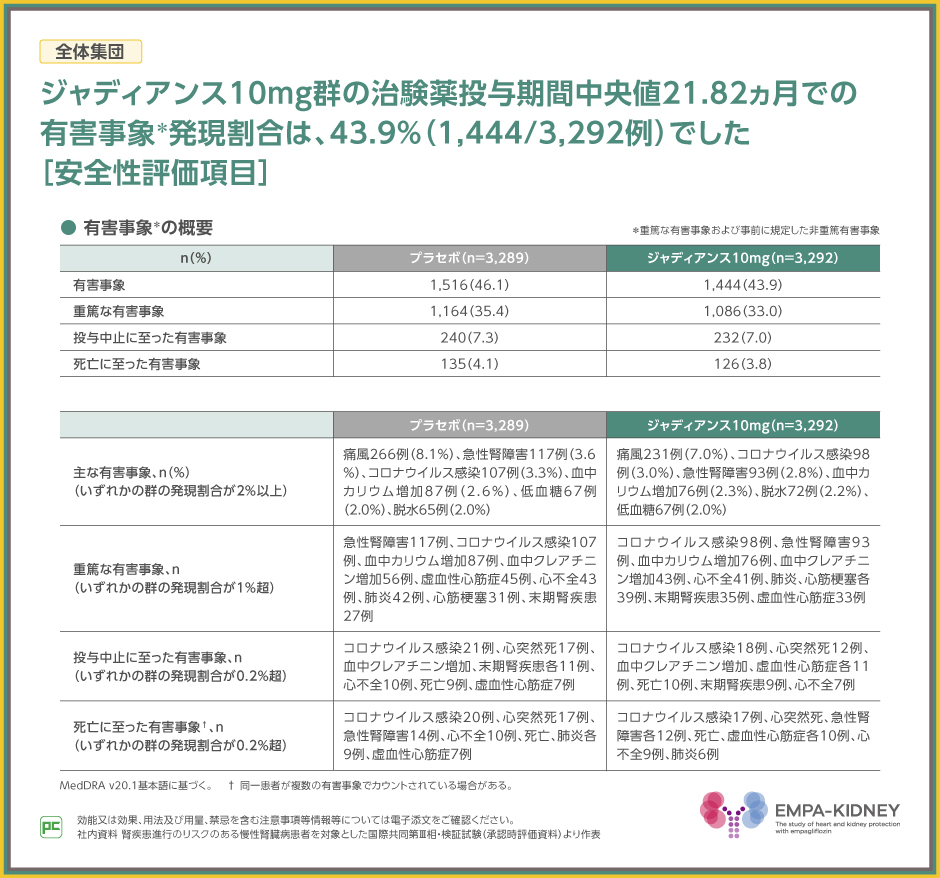
EMPA-KIDNEY試験において、事前に規定した非重篤有害事象および全ての重篤な有害事象に限定して有害事象を収集した結果、全体集団での発現割合はジャディアンス10mg群で43.9%でした。
主な有害事象は、ジャディアンス10mg群で痛風7.0%、コロナウイルス感染3.0%、急性腎障害2.8%等でした。
また、重篤な有害事象は、ジャディアンス10mg群でコロナウイルス感染98例、急性腎障害93例、血中カリウム増加76例等でした。
なお、投与中止、死亡に至った有害事象は表のとおりでした。

EMPA-KIDNEY試験における日本人集団での発現割合はジャディアンス10mg群で37.7%でした。
主な有害事象は、ジャディアンス10mg群で低血糖3.1%、白内障手術2.7%、脱水2.1%等でした。
また、重篤な有害事象は、ジャディアンス10mg群で白内障手術8例、末期腎疾患5例、動静脈シャント手術4例等でした。
なお、投与中止、死亡に至った有害事象は表のとおりでした。

EMPEROR-Reduced試験、EMPEROR-Preserved試験において心不全に対する有効性が評価されたジャディアンス錠10mgは、左室駆出率を問わず慢性心不全※1への処方が可能です。
また、EMPA-KIDNEY試験により、2型糖尿病を併発していない慢性腎臓病に対する有効性も評価されました。
慢性心不全※1や慢性腎臓病※2の患者さんの治療にジャディアンス錠10mgの処方をご検討ください。
※1 ただし、慢性心不全の標準的な治療を受けている患者に限る。
※2 ただし、末期腎不全又は透析施行中の患者を除く。
日本ベーリンガーインゲルハイム
メディカルチャット 利用規約
当社の「日本ベーリンガーインゲルハイム メディカルチャット」(以下「本サービス」といいます)のご利用に際しては、本利用規約が適用されますので、必ず以下の記載事項をご確認下さい。
利用規約
- 本サービスは、当社所定のウェブページから文字によりお問い合わせいただくことにより、当社医薬品等に関する一般的な情報を、人工知能あるいは当社担当者により、文字及び図表により回答するサービスです(以下、人工知能による回答サービスを「AIチャット」、当社担当者による回答サービスを「有人チャット」といいます。)。ただし、AIチャットによる回答を原則とし、有人チャットは、AIチャットでの回答に対し、有人チャットでの回答も希望された場合に、提供させていただきます。
- 本サービスをご利用いただくことができるのは、当社医薬品等を扱いかつ国内に在住する医療関係者の方に限られます。当該医療関係者以外の方は、ご利用いただくことができません。
- 本利用規約に同意いただけない場合、本サービスを利用いただくことができません。本利用規約を最後までお読みいただき、「同意して利用する」ボタンを押した上で、本サービスをご利用下さい。
- 本サービスは、当社医薬品等に関する一般的なお問い合わせに対して回答するものとし、次の各号に掲げるお問い合わせについては、回答しないものとします。
- 当社医薬品等と関係のないお問い合わせ、または本サービスの回答範囲を逸脱したお問い合わせ
- 具体的な症状や治療方法に関するお問合せ
- 当社に適用される法令、ガイドラインまたは行政上の指導、当社自主規制その他当社が遵守すべきルールにより回答できないお問い合わせ
- 文字化け等により入力内容が判断できないお問い合わせ
- 前各号に掲げるほか、本サービスにより、適切な回答をすることができないと当社が判断した事項に関するお問い合わせ
- 本サービスは、日本語のみに対応しています。
- 本サービスは、当社医薬品の副作用、不具合及び有害事象の報告を受け付けていません。
- お問い合わせの内容によっては、本サービスでは十分に回答できない場合もございます。予めご了承下さい。
- 本サービスの利用可能時間は、以下のとおりです。
- AIチャット
24時間365日 - 有人チャット
平日9:00~17:00
- AIチャット
- 前項に関わらず、メンテナンス及び障害等のため一時的に本サービスを中断する場合がございます。
本サービスのご利用の際には、原則として、個人情報(お名前、ご住所、電話番号、メールアドレス等)を入力しないようお願いします。ただし、AIチャット及び有人チャットを問わず、当社医薬品の適用外使用に関するお問い合わせについては、コンプライアンス上の理由により、当社より、氏名及び施設名の入力を求める場合がございます。この場合には、当社プライバシーポリシーの内容を確認いただき、同意いただける場合に限り、入力して下さい(プライバシーポリシーについては「VIII 利用規約、プライバシーポリシー」に記載のURLからアクセス下さい)。その他の場合に、当社より個人情報の入力を求めることは一切ございません。
- 当社医薬品のご使用にあたっては、最新の添付文書等をご確認下さい。
- 当社は、本サービスまたは本サービスにより提供される情報の利用に際し生じた結果については、一切責任を負いません。
本サービスの利用にあたり、以下の各号の行為を禁止します。
- 本サービスにより提供される情報を複製、複写、転載、改変等する行為
- 第三者または当社の知的財産権その他の権利を侵害する行為
- 第三者または当社を誹謗中傷し、または名誉・信用を毀損する行為
- 本サービスの利用による営利目的の行為
- 本サービスの運営又は他の利用者による本サービスの利用の妨げとなる行為
- 前各号のほか、当社が不適当であると判断する行為
当社は、いつでも本サービスの提供を終了、またはその内容を変更することができるものとします。
本サービスの利用に関しては、以下の利用規約及びプライバシーポリシーが併せて適用されますので、ご確認下さい。


