
生存期間延長を考慮したシークエンス治療 肺癌診療GL改訂を踏まえて
サイトへ公開:2024年10月02日 (水)
解良 恭一 先生(埼玉医科大学国際医療センター 呼吸器内科 教授)

近年、EGFR遺伝子変異陽性非小細胞肺癌は治療選択肢が広がり、さまざまな治療戦略が考えられるようになってきました。
今回は、埼玉医科大学国際医療センター 呼吸器内科 教授 解良 恭一先生に、生存期間(OS)延長を考慮したシークエンス治療の重要性や、ガイドライン改訂による治療戦略への影響、薬物治療を検討する患者さんへの説明のポイントなどをお伺いしました。
OS延長を考慮したⅣ期EGFR遺伝子変異陽性非小細胞肺癌のシークエンス治療
Ⅳ期EGFR遺伝子変異陽性非小細胞肺癌の薬物治療で重要視されていることを教えてください。

やはりⅣ期の薬物治療では、少しでもOSを延長してあげることが重要だと私は考えています。
副作用はもちろん問題ですが、医療者がきちんと薬剤の特性を理解していれば、副作用マネジメントは可能であると思います。そのため、特に優先しているのはOSの延長です。
OS延長に向けて治療選択において重視するポイントを教えてください。
OS延長のためには、一次治療だけではなく二次治療以降も含めたシークエンスを考えた治療選択が非常に重要であると考えています。
なぜなら、EGFR遺伝子変異陽性のⅣ期非小細胞肺癌に対する治療選択肢が広がる中で、後治療をどう組み合わせるかによって、シークエンス治療全体のOSが変わってくると考えられるからです。
先生はシークエンス治療の方針をどのように考えていますか。

まず一次治療では、EGFR-TKIの使用を考慮します。二次治療以降では、大きく二つの治療戦略を取っています。
一つは、一次治療の薬剤とは異なる作用機序の薬剤を使用することです。たとえば、長期での無増悪生存期間(PFS)を期待して、化学療法2剤+血管新生阻害薬+免疫チェックポイント阻害薬による4剤併用療法を考慮することもあります。
もう一つは、(一次治療と同じ、あるいは異なる)EGFR-TKIのリチャレンジです。リチャレンジを考慮するのは、初回治療でEGFR-TKIに対する感受性が高いと考えられる症例です。このような患者さんに対し、二次治療以降にもEGFR-TKIの可能性を残しておくことはOS延長に向けた価値のある治療戦略と考えています。
肺癌診療ガイドライン2023年版1)におけるEGFR遺伝子変異陽性の一次治療に関する解釈
今回のガイドライン改訂で、Common mutation例への一次治療におけるジオトリフ単剤療法については、Clinical Question(CQ)からBackground Question(BQ)への記載となりました。
この改訂は、先生が重要視されているOSを考慮した治療戦略にどのような影響を与えますか?
特に影響はありません。なぜなら、今回の改訂は、あくまでも実施された臨床試験のデザインの違いにより、薬剤の記載がCQとBQに整理されたと考えられるからです。
そのデザインの違いとは、第一世代EGFR-TKIを対照群とした第Ⅲ相試験が実施されているか否かです。今回の改訂では、前者がCQに、後者がBQに整理されたと考えています。
ジオトリフについては第一世代EGFR-TKIを対照にした第Ⅱ相試験(LUX-Lung 7試験)2)が行われていますが、第Ⅲ相試験としては化学療法との比較(LUX-Lung 3試験)3)となっています。
ジオトリフに関して治療方針を検討する上で重視しているデータ
日本人集団のサブグループ解析が実施されているLUX-Lung 3 検証試験(国際共同第Ⅲ相臨床試験)
治療戦略を検討する上で、日本人データは非常に参考になります。その背景には、EGFR遺伝子変異の発現頻度は人種差があり、日本人を含むアジア人では欧米人と比べて頻度が高いことがあります4)。発現頻度が異なるということは、薬剤感受性やシークエンス治療の効果など、EGFR-TKIによる治療の影響が欧米人と日本人とでは異なる可能性があるということです。
ジオトリフは、LUX-Lung 33)において、日本人集団のサブグループ解析によるPFS、OSと安全性プロファイルが示されており、症例数は83例と少ないものの、われわれの日常診療の参考になるデータであると考えています。
さらに、新たなデータとして、国内のEGFR遺伝子変異陽性非小細胞肺癌患者を対象に、PFSやOS、安全性などを検討したEXTRA試験5)の結果が報告され、ジオトリフの日本人データが蓄積されています。
LUX-Lung 3では、EGFR遺伝子変異陽性非小細胞肺癌を対象に、一次治療におけるジオトリフ単独療法とPEM+CDDP併用化学療法の有効性と安全性を検討しました。

主要評価項目であるPFS中央値は、ジオトリフ群11.1ヵ月、PEM+CDDP群6.9ヵ月であり、ジオトリフ投与によるPFSの有意な延長が検証されました。
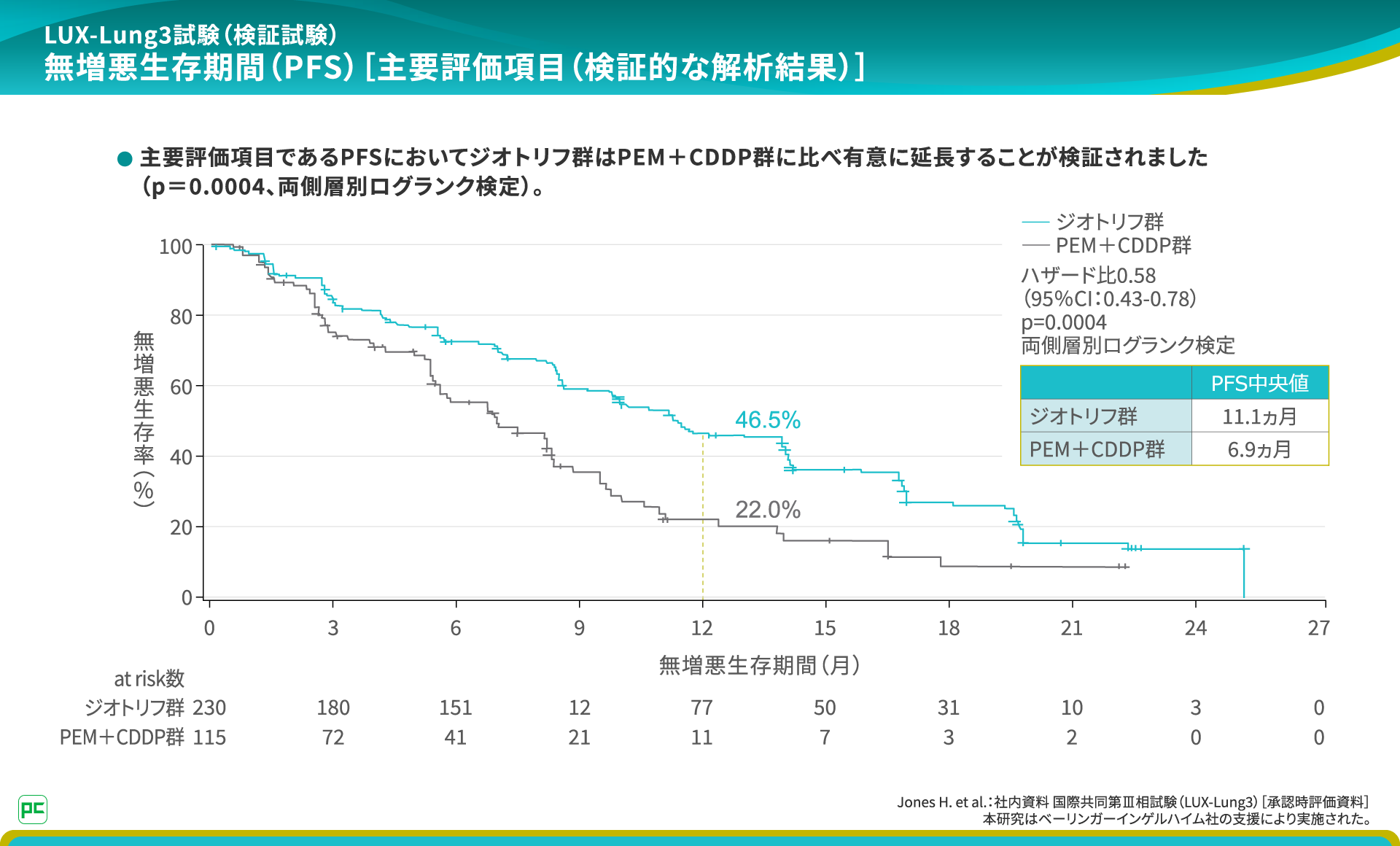
副作用は、ジオトリフ群229例中228例、99.6%に認められました。
主な有害事象は、ジオトリフ群で下痢、発疹/ざ瘡、口内炎、爪の異常など、PEM+CDDP群で悪心、食欲減退などでした。

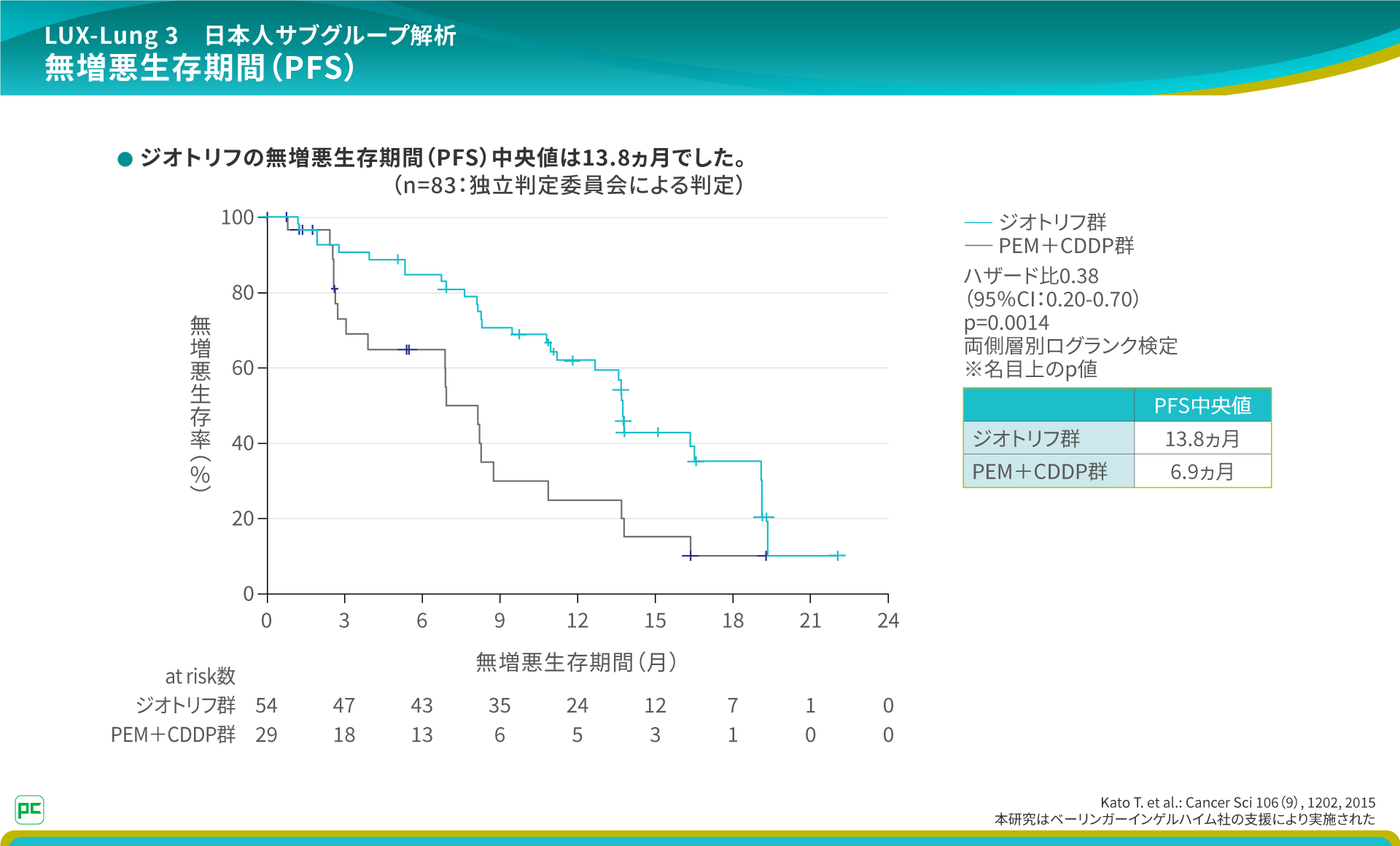
日本人サブグループにおけるPFS中央値は、ジオトリフ群13.8ヵ月、PEM+CDDP群6.9ヵ月で、ジオトリフ投与による62%の再発リスク低下が認められました。
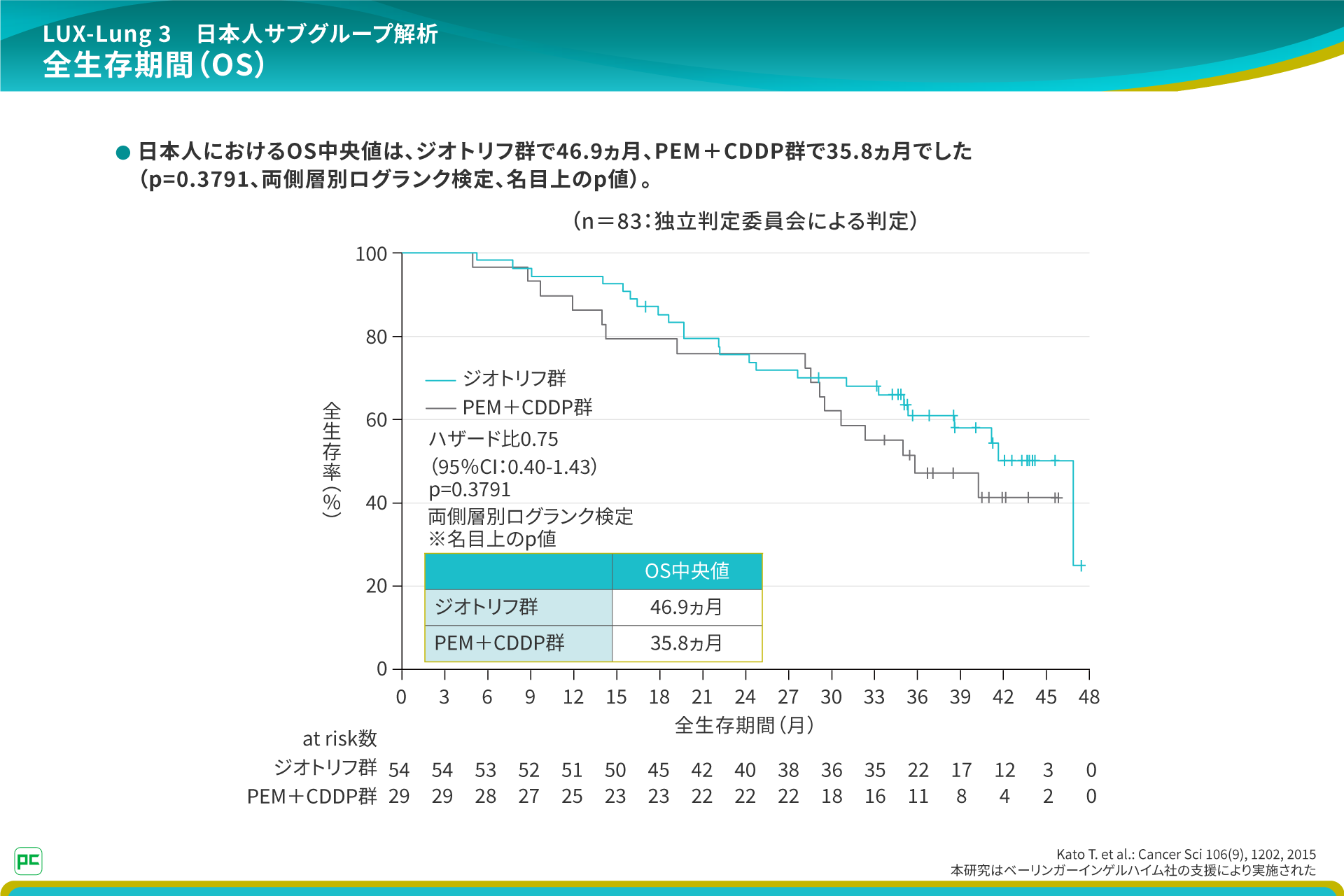
また、日本人におけるOS中央値は、46.9ヵ月で、PEM+CDDP群で35.8ヵ月でした。
日本人における副作用は、ジオトリフ群において100%で認められました。
主な有害事象は、ジオトリフ群で下痢、発疹/ざ瘡、爪の異常など、PEM+CDDP群で悪心、食欲減退、好中球減少症、白血球減少症、疲労などでした6)。

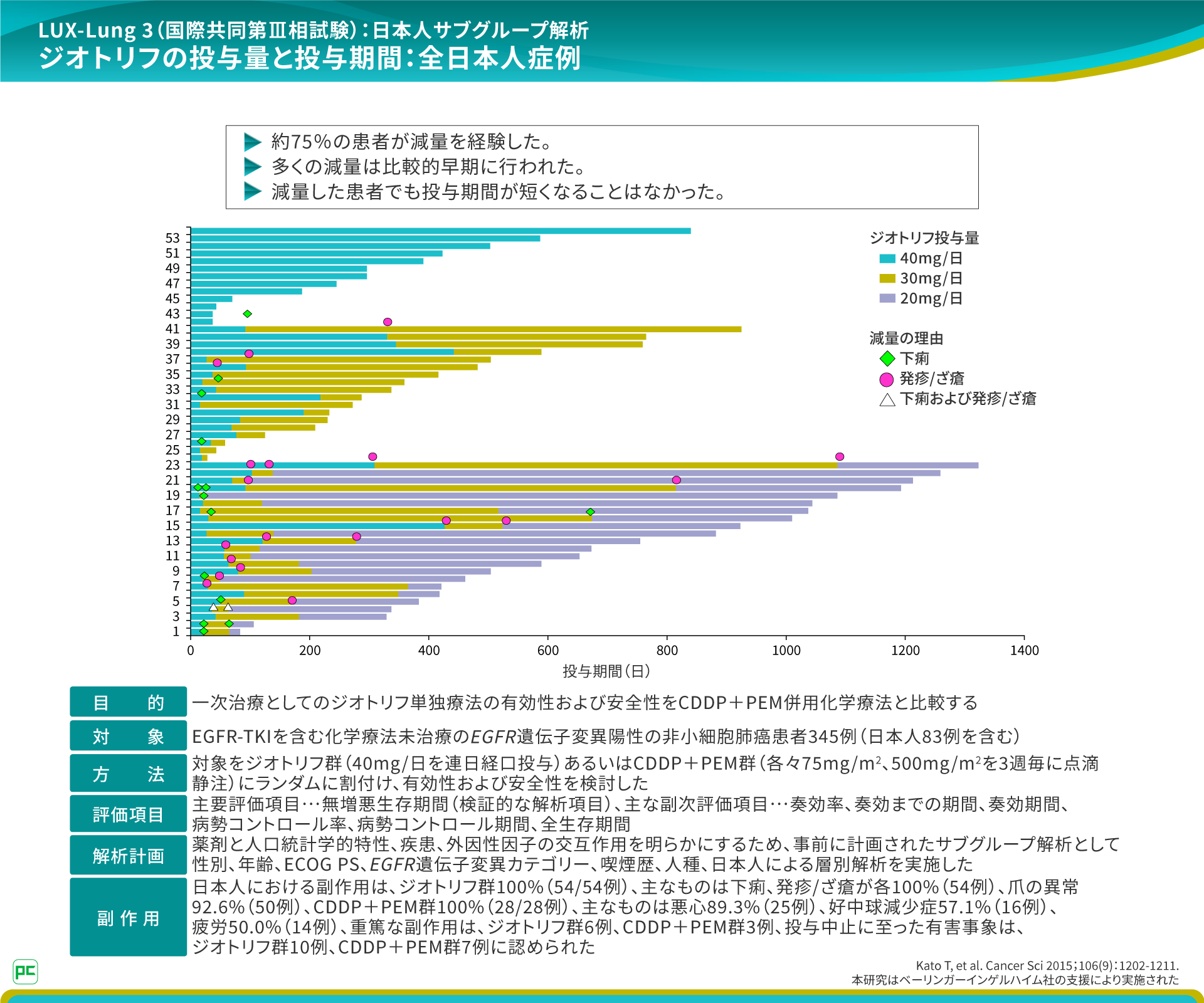
下痢などの副作用マネジメントの観点からジオトリフを減量して使用する場合もありますが、そのときに参考になるのが投与量と投与期間を検討した日本人データです。
約75%の患者が減量を経験し、その多くは比較的早期に減量が行われました。また、減量を通じて、ジオトリフを長期的に継続できる患者の存在が確認されました。
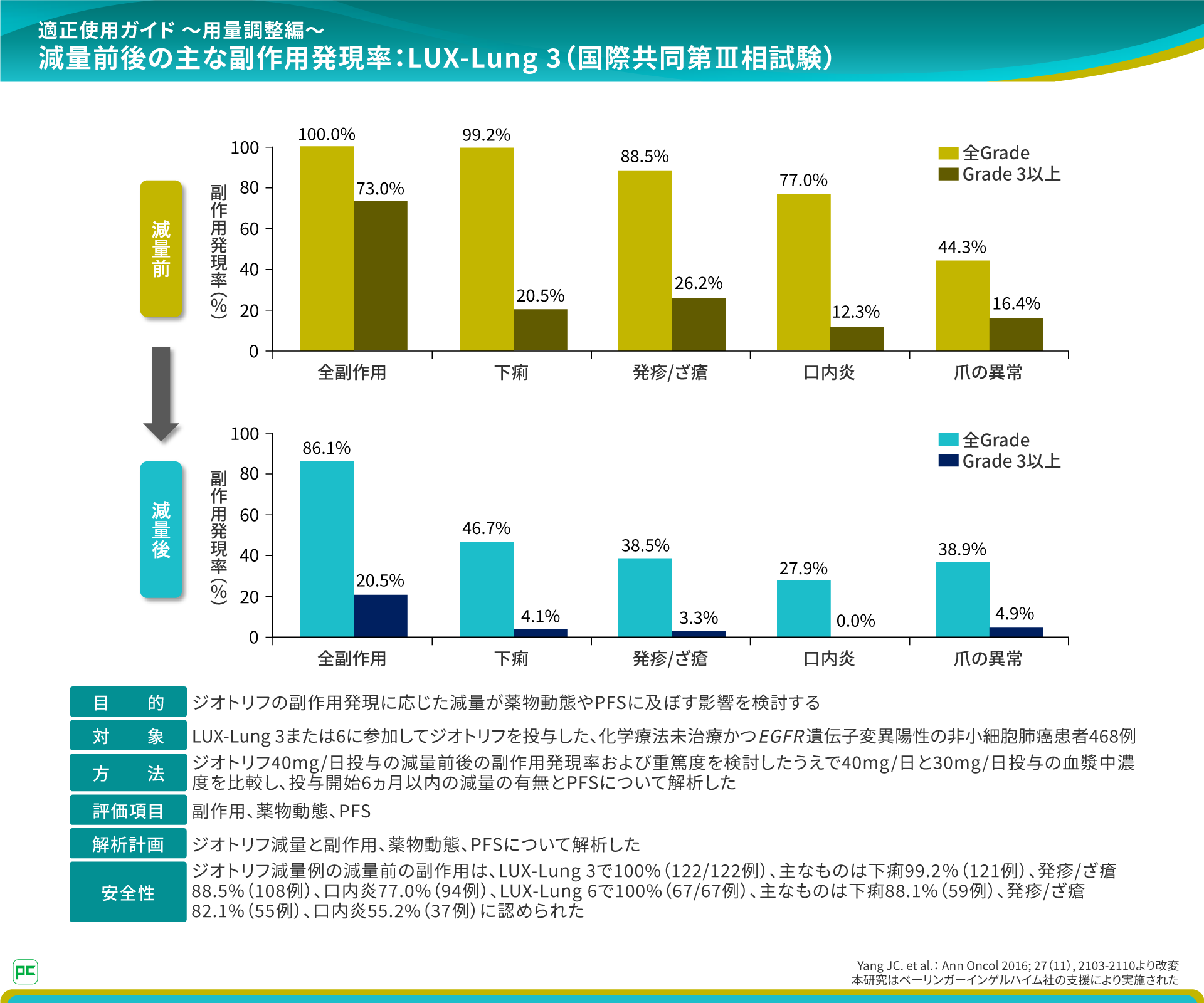
本試験では減量前後における副作用発現率を検討しています7)。
全副作用発現率は減量前100%であり、減量後は86.1%でした。主な副作用として減量前は下痢99.2%、発疹/ざ瘡88.5%などが認められたのに対し、減量後は下痢46.7%、発疹/ざ瘡38.5%などでした。
これらの減量に関するデータから、副作用が発現した場合は、適切な減量により長期継続することで、ジオトリフのベネフィットを引き出すことができると考えられます。
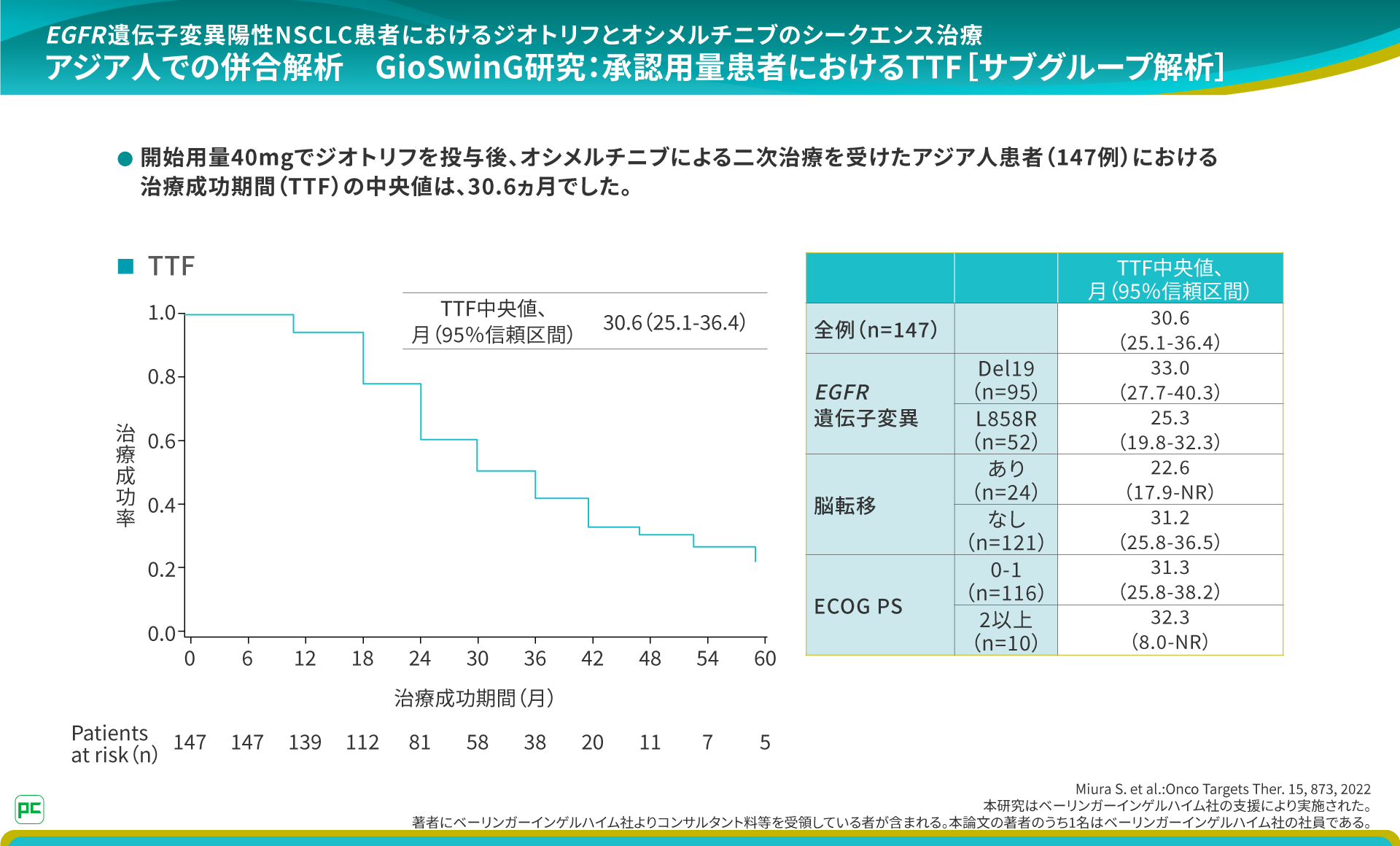
シークエンス治療の有用性を検討したGioSwinG研究8)
シークエンス治療の戦略を考えるに当たり参考にしているのは、ジオトリフとオシメルチニブの治療の順番を検討した国際多施設共同後ろ向き観察研究のGioSwinG研究です。
EGFR遺伝子変異陽性非小細胞肺癌患者においてジオトリフによる一次治療後にT790M変異を獲得し、オシメルチニブによる二次治療を行ったアジア人168例のデータが報告されています。

開始用量40mgでジオトリフを投与後、オシメルチニブによる二次治療を受けたアジア人患者(147例)における治療成功期間(TTF)の中央値は、30.6ヵ月でした。
また、OSの中央値は、45.2ヵ月でした。
このアジア人における解析結果から、長期のOSを目指す治療戦略として、ジオトリフからオシメルチニブにつなげるシークエンス治療は重要な選択肢のひとつであると考えています。
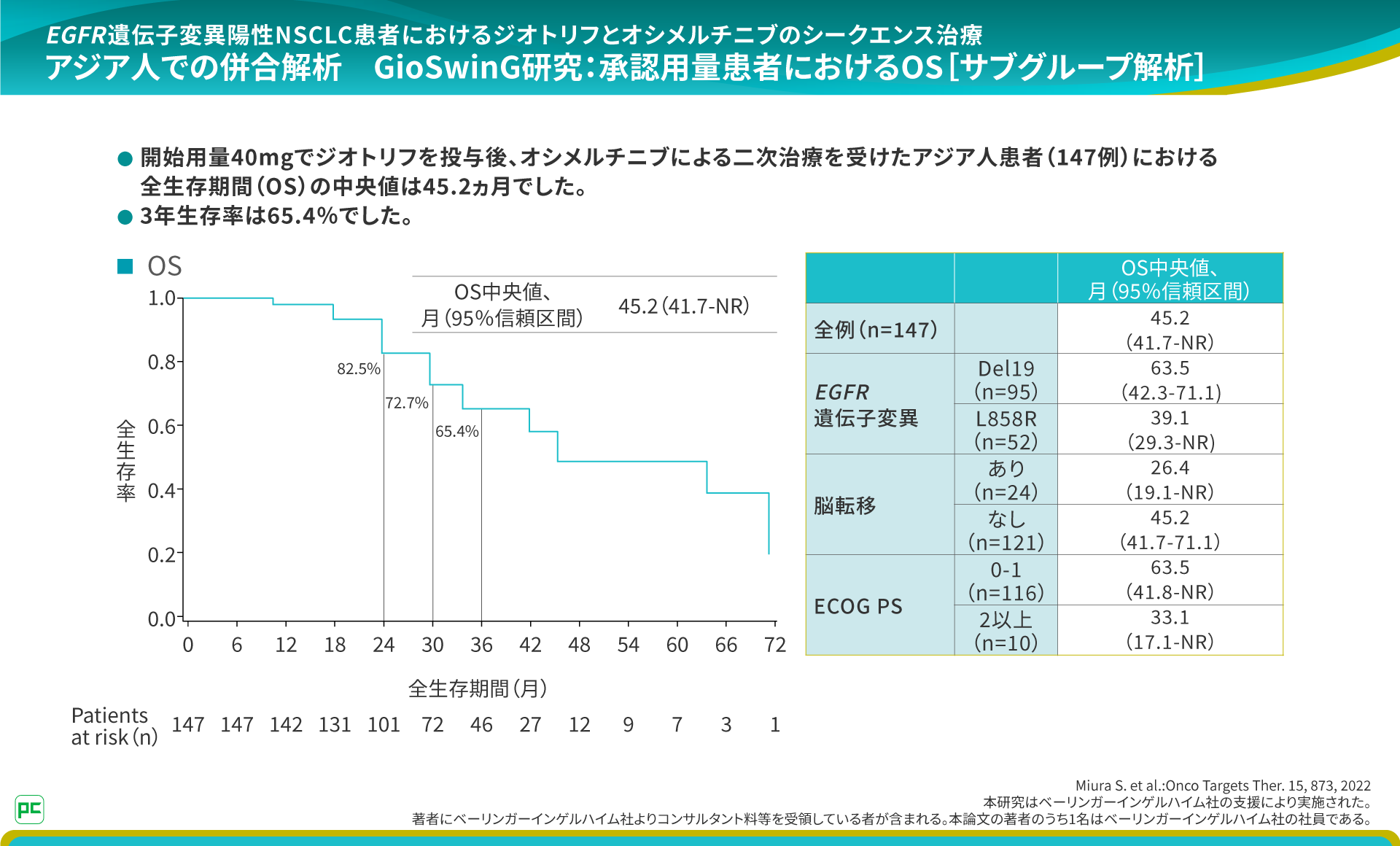
なお、本研究では、安全性情報を収集していません。

薬物治療の検討における患者とのコミュニケーション
長期生存を見据え、薬物治療を開始する患者さんへ説明するポイントを教えてください。
主にシークエンス治療による長期生存の可能性と副作用の2点を説明しています。
患者さんの多くが心配されるのは、初回治療が終了した後に、有効な治療方法が残っているかどうかです。そのため、初回治療で期待される効果だけでなく、もしその治療が効かなくなったとしても、次に投与できる薬剤の種類がいくつかあることを説明しています。先ほどご紹介したEGFR-TKIのリチャレンジを含め、長期生存に向けてできる限り多くの治療機会を提供できるようにするということを伝えるのが大切だと考えています。
また、副作用の特徴やそのマネジメント方法を十分に説明した上で、患者さんに合った治療戦略を考えています。特に全身状態が悪く、なかなか長期生存が難しいと考えられるような患者さんでは、ご本人への負担の少なさをより重視して治療を選択するケースもあります。
ジオトリフの副作用である下痢のマネジメントについてどのように説明されますか。

「下痢が起こった場合は、お薬を減量することであなたにとって服用を継続しやすい、適切な量に調整していきます」という説明をします。
ジオトリフ開始後は、患者さんに下痢の有無や頻度、性状を聞き取ります。下痢があってもお薬で問題なくコントロールできているようであれば、しばらくその用量で継続し、日常生活に支障を来すようであれば、その時点で減量することを提案します。このように、患者さんにとって適切な量に速やかに減量することが重要であると考えています。
【引用】
- 日本肺癌学会: 肺癌診療ガイドライン 2023年版
- Park K. et al.: Lancet Oncol 17(5), 577, 2016
本研究はベーリンガーインゲルハイム社の支援により実施された。 - 社内資料 国際共同第Ⅲ相試験(LUX-Lung 3) [承認時評価資料]
本研究はベーリンガーインゲルハイム社の支援により実施された。 - Sekine I. et al.: Br J Cancer. 2008; 99(11): 1757-1762
- Takata S. et al.: Ther Adv Med Oncol, 2023; 15: 1-14
本研究はベーリンガーインゲルハイム社の支援により実施された。著者にベーリンガーインゲルハイム社よりコンサルタント料等を受領している者が含まれる。本論文の著者のうち1名はベーリンガーインゲルハイム社の社員である。 - Kato T. et al.: Cancer Sci 106(9), 1202, 2015
本研究はベーリンガーインゲルハイム社の支援により実施された。 - Yang JC. et al.: Ann Oncol 2016; 27(11), 2103-2110
本研究はベーリンガーインゲルハイム社の支援により実施された。 - Miura S. et al.: Onco Targets Ther. 15, 873, 2022
本研究はベーリンガーインゲルハイム社の支援により実施された。著者にベーリンガーインゲルハイム社よりコンサルタント料等を受領している者が含まれる。本論文の著者のうち1名はベーリンガーインゲルハイム社の社員である。
その他の関連情報





